山东师范大学唐波/李平JACS:开发了一种双色/双可逆荧光探针成像揭示超氧阴离子和ATP在肝脏缺血再灌注损伤中的关键作用
时间:2023-09-06 18:53:35 热度:37.1℃ 作者:网络
【引言】
肝脏缺血再灌注损伤(HIRI)是肝脏切除手术和肝脏移植手术中不可避免的并发症,是术后肝功能障碍和肝功能衰竭的主要原因。在HIRI发展进程中,加剧的氧化应激与受损的能量代谢协同作用,共同在肝损伤中发挥重要作用。超氧阴离子(O2•−)和三磷酸腺苷(ATP)分别为氧化应激和能量代谢相关的关键生物标志物。然而,由于缺乏合适的原位成像工具,O2•−和ATP在HIRI中的时空波动以及它们如何协同参与HIRI的病理机制目前尚不清楚。现有的O2•−或ATP响应型荧光探针由于其不可逆机制,不适合动态监测HIRI过程中O2•−和ATP的水平变化。因此,迫切需要开发一种荧光探针,能够在HIRI过程中同时、可逆地检测O2•−和ATP,这不仅能够监控HIRI过程中O2•−和ATP的时空、动态变化,而且有望揭示O2•−和ATP在HIRI中的相关性及调控机制。
【成果简介】
基于以上背景,山东师范大学唐波教授/李平教授课题组发展了一种双色双可逆分子荧光探针(UDP)用于HIRI过程中O2•−和ATP的实时、动态和同步可视化,并揭示了它们在HIRI中的相互关系和协同作用。该成果以“Unveiling the Crucial Roles of O2•− and ATP in Hepatic Ischemia−Reperfusion Injury Using Dual-Color/Reversible Fluorescence Imaging”为题发表在国际权威杂志Journal of the American Chemical Society上。该项研究工作也是唐波教授/李平教授课题组于2022年在Journal of the American Chemical Society(J. Am. Chem. Soc., 2022, 144, 1, 174–183; J. Am. Chem. Soc., 2022, 144, 30, 13586–13599)上发表关于药物诱导的肝损伤ONOO−和ATP的单/双光子成像与NIR-Ⅱ荧光引导HIRI的精准导航工作之后,在肝损伤研究方面取得的又一个突破性研究结果。文章第一作者是山东师范大学博士研究生刘继红,山东师范大学张雯副教授、巴斯大学吴庐陵博士、Tony D. James教授、山东师范大学李平教授和唐波教授为论文共同通讯作者。
本文中,作者报道了一种兼具双色和双可逆性质的荧光探针(UDP),UDP对O2•−和ATP的响应具有优异的灵敏度、选择性和可逆性,这使得UDP能够在蓝色和红色荧光通道中独立响应O2•−和ATP水平变化,没有光谱串扰。UDP在HIRI过程中的原位成像首次揭示了肝细胞和小鼠肝脏的同步O2•−爆发和ATP消耗。作者揭示了HIRI过程中细胞内的O2•−—琥珀酸脱氢酶(SDH)—线粒体内的还原型烟酰胺腺嘌呤二核苷酸(NADH)—线粒体内的ATP—细胞内的ATP级联信号通路,首次阐明了O2•−和ATP在HIRI过程中的关联性。这项工作证实了UDP在动态监测HIRI和揭示HIRI发病机理的巨大潜能。
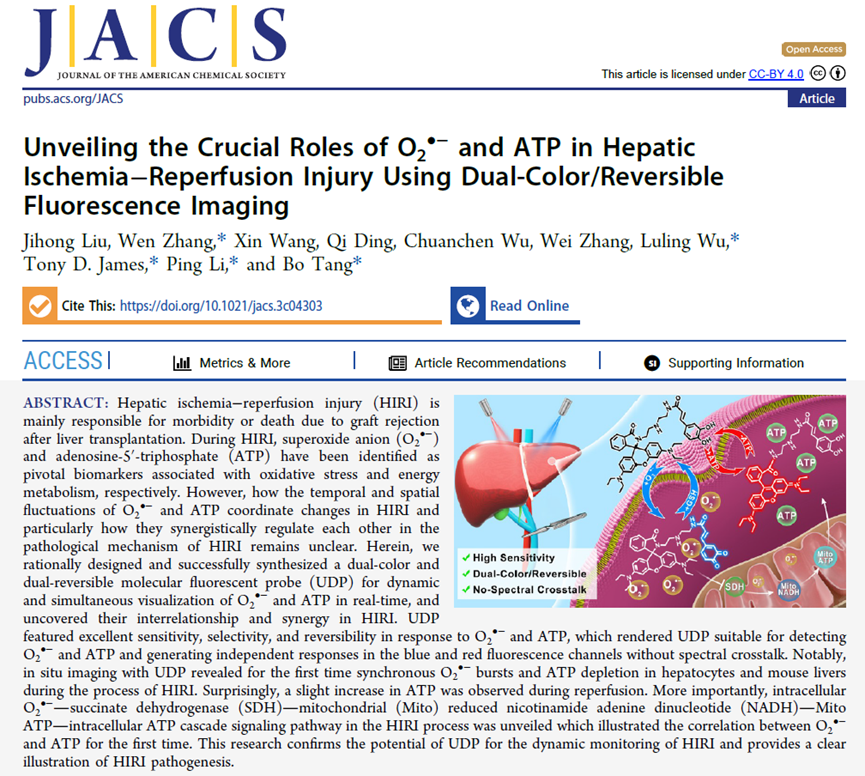
图1 UDP的结构和荧光性质。(A)UDP响应O2•−和ATP的可逆发光机制。为了构建O2•−和ATP双可逆响应的荧光探针,咖啡酸与罗丹明B分别作为O2•−和ATP特异性的识别基团和相应的荧光团,二者通过二乙烯三胺连接。作为常用的O2•−清除剂,咖啡酸被用作O2•−高特异性的识别基团,O2•−特异性氧化咖啡酸中的对苯二酚基团生成苯醌,从而促进蓝色荧光的产生。修饰二乙烯三胺的罗丹明螺内酰胺衍生物由于具有多个氨基,已被证明是ATP高灵敏和选择性的响应位点。咖啡酸基团与O2•−的反应过程和罗丹明螺内酰胺部分与ATP的结合作用均具有可逆性,有望动态追踪O2•−和ATP水平变化。(B)UDP响应不同浓度O2•−的荧光光谱。(C)UDP在470 nm处的荧光强度与O2•−水平的关系。(D)UDP的O2•−通道对常见干扰物质的选择性。(E)UDP响应不同浓度ATP的荧光光谱。(F)UDP在588 nm处的荧光强度与ATP水平的关系。(G)UDP的ATP通道对常见干扰物质的选择性。

图2 UDP的可逆性、光谱串扰和生物毒性评价。(A)添加O2•−(65 μM)和GSH(200 μM)后,UDP蓝色荧光的可逆响应循环。(B)在22 mM ATP存在下,加入不同浓度的O2•−(0-65 μM)后,UDP在O2•−通道的荧光光谱。(C)与65 μM O2•−和22 mM ATP反应前后UDP的吸收光谱。(D)添加ATP(22 mM)和三磷酸腺苷双磷酸酶(1 U/N)后,UDP红色荧光的可逆响应循环。(E)在65 μM O2•−存在下,加入不同浓度的ATP(0-22 mM)后,UDP在ATP通道的荧光光谱。(F)UDP的生物毒性评估。

图3 2-甲基雌二醇(2-ME)或寡霉素A(Omy A)刺激肝细胞中O2•−和ATP波动的共聚焦荧光成像。(A)2-ME(O2•−刺激剂)和钛铁试剂(O2•−清除剂)处理的肝细胞O2•−(蓝色通道,λex = 405 nm, λem = 420-490 nm)和ATP(红色通道,λex= 514 nm, λem = 525-668 nm)的共聚焦荧光成像。(B)Omy A(ATP抑制剂)和ATP处理的肝细胞O2•−和ATP的共聚焦荧光成像。(C, D)分别为(A, B)的相对蓝色和红色荧光强度输出。
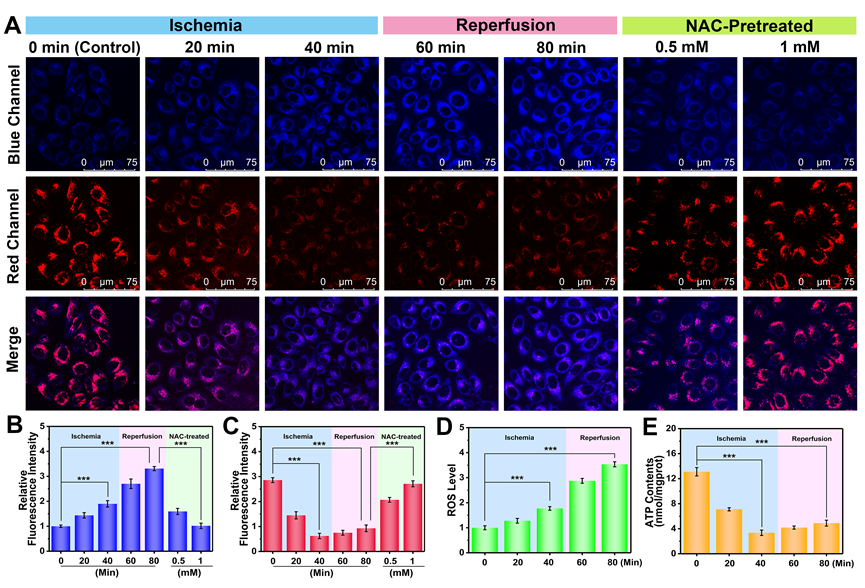
图4 HIRI全过程中肝细胞O2•−和ATP波动的动态可视化及HIRI药物NAC的干预效果。(A)缺血0分钟、20分钟、40分钟,缺血40分钟后再灌注20分钟、缺血40分钟后再灌注40分钟以及0.5 mM、1 mM NAC预处理组肝细胞对O2•−(蓝色通道,λex = 405 nm, λem = 420-490 nm)和ATP(红色通道,λex= 514 nm, λem = 525-668 nm)进行荧光成像。(B, C) A图的相对蓝色和红色荧光强度输出。(D) ROS含量测定试剂盒测定HIRI不同时期的相对ROS水平。(E) ATP含量测定试剂盒测定HIRI不同时期的ATP水平。
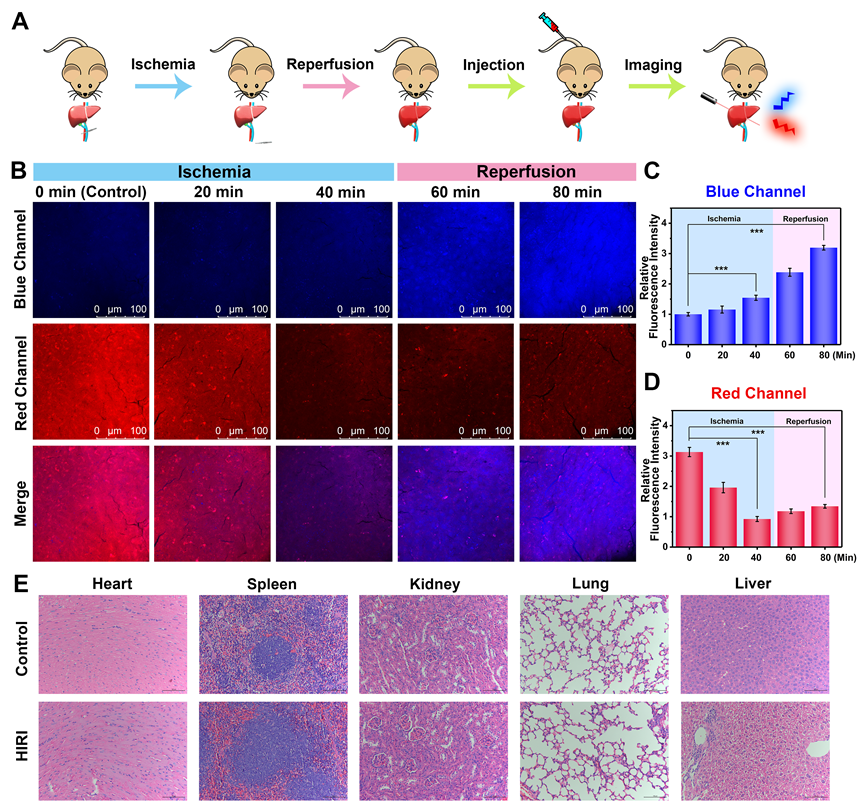
图5 HIRI期间小鼠肝脏中O2•−和ATP动态的实时可视化。(A)操作示意图。(B)缺血0分钟、缺血20分钟、缺血40分钟及缺血40分钟再灌注20分钟、缺血40分钟再灌注40分钟小鼠肝脏中O2•−(蓝色通道,λex= 405 nm, λem = 420-490 nm)和ATP(红色通道,λex = 514 nm, λem = 525-668 nm)的荧光成像。(C, D) B图的相对蓝色和红色荧光强度输出。
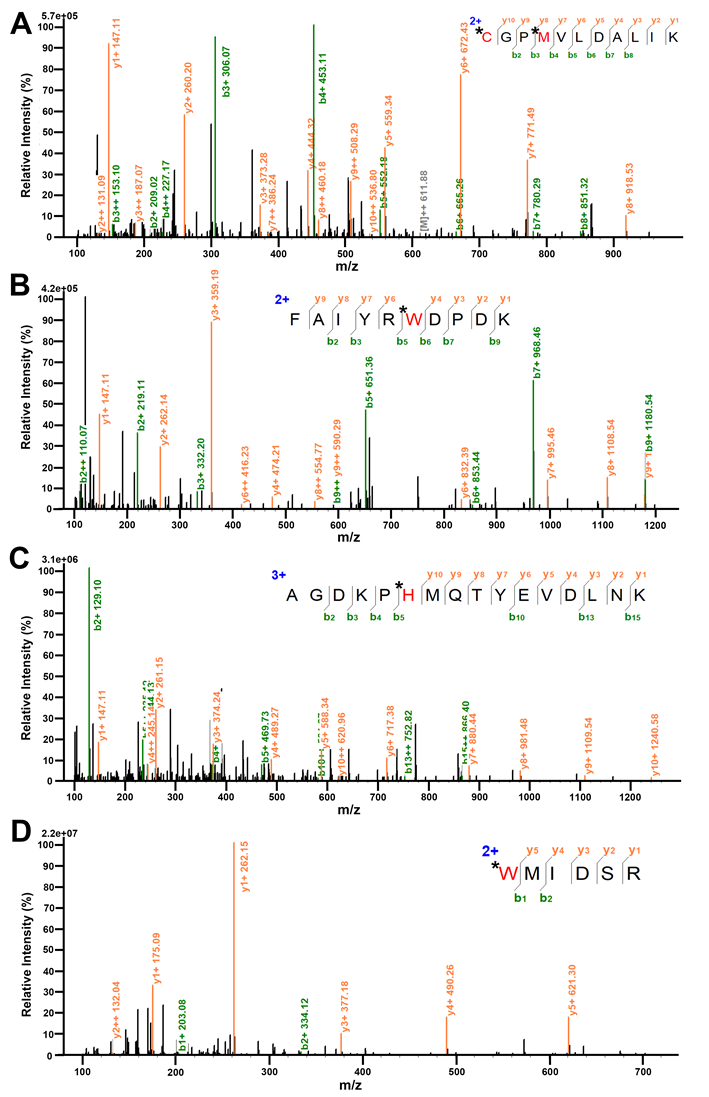
图6 通过LC-MS/MS分析琥珀酸脱氢酶与O2•−反应的蛋白质组学。(A) C68, M71的氧化。(B) W47的氧化。(C) H57的氧化。(D) W218的氧化。*和红色表示的残基代表O2•−的修饰位点。

图7 HIRI过程中细胞内的O2•−—SDH—线粒体内的NADH—线粒体内的ATP—细胞内的ATP级联信号通路。(A)经不同处理的肝细胞的SDH活性分析。(B-C)经不同处理的肝细胞线粒体NADH含量。(D)经不同处理的肝细胞线粒体ATP含量。(E)在3-NPA作用下,使用UDP荧光成像肝细胞ATP。(F) E图的相对红色荧光强度输出。(G)经不同处理的肝细胞细胞ATP含量。(H)HIRI过程中细胞内的O2•−—SDH—线粒体内的NADH—线粒体内的ATP—细胞内的ATP级联信号通路。
【总结与展望】
本文成功开发了一个对O2•−和ATP具有高灵敏度和卓越选择性响应的双色双可逆的分子平台(UDP)。UDP能够同时、可逆响应O2•−和ATP,并且独立监控蓝色和红色通道内的荧光,而不受光谱串扰的影响。得益于探针在体外响应O2•−和ATP出色的性能,UDP成功被用于同时成像与动态监测肝细胞内源性的O2•−和ATP水平。通过分离良好的蓝、红光,UDP进一步被用来实时、原位可视化HIRI全过程中肝细胞内O2•−和ATP及HIRI药物的干预效果。更重要的是,UDP成功实现了HIRI过程中小鼠肝脏内O2•−和ATP的可视化。最后,本文首次揭示了HIRI过程中细胞内的O2•−—SDH—线粒体内的NADH—线粒体内的ATP—细胞内的ATP级联介导的信号通路。这项工作报道了首个研究HIRI中O2•−和ATP之间相关性和协同作用的荧光探针,有望为深入了解HIRI进展中相互联系的活性分子之间的相互作用提供多种机会。
原文链接:
https://doi.org/10.1021/jacs.3c04303


