ATVB 青岛大学医学部转化医学研究院王栋团队揭示微血管周细胞分化新机制
时间:2023-09-03 14:42:42 热度:37.1℃ 作者:网络
微血管病变与各个组织和器官的疾病发生密切相关,其中一个较为普遍的疾病是组织纤维化,据统计约45%的死亡与组织纤维化相关。组织纤维化是指器官中过度沉积大量胞外基质蛋白,导致组织变硬,同时伴随着微血管退化,最终导致器官功能衰竭甚至死亡,例如肺脏纤维化导致呼吸功能衰退,肾脏纤维化导致肾衰竭,肝脏纤维化导致肝硬化和肝癌的发生。组织纤维化的发生原因是多方面的,其中一个重要细胞来源是微血管周细胞(pericyte)分化形成肌成纤维细胞(myofibroblast),后者构成纤维化组织的主要细胞类型,深入研究周细胞分化调控机制有助于发现新的药物靶点及其临床转化。
已有大量实验室研究利用动物模型或细胞培养模型来探索纤维化发生机制,寻求可能的药物靶点,一些研究进入临床试验阶段,但是目前获得批准的药物极少。究其原因,一方面,动物模型的研究在向临床转化时存在物种差异的风险;另一方面,利用人的细胞建立原代细胞模型可以避免物种差异,但是目前的细胞培养模型较为简单,大多数研究利用细胞系,难以模拟体内微血管微环境。在实验室前期研究中,王栋团队建立了一种新的原代微血管培养模型(Journal of Tissue Engineering, 2022, 13: 20417314221125310),可以在体外长期培养原代微血管,同时保留来自同一组织的微血管内皮细胞和周细胞,较好的保留了微血管微环境,为研究周细胞提供了一个有力的平台工具。
2023年8月31日,青岛大学医学部转化医学研究院王栋团队在Arteriosclerosis, Thrombosis, and Vascular Biology杂志上发表了题为“Extracellular matrix stiffness regulates microvascular stability by controlling endothelial paracrine signaling to determine pericyte fate”的论文,揭示了胞外基质硬度通过Integrin β1调控微血管内皮细胞旁分泌信号通路从而诱导周细胞分化为肌成纤维细胞的作用机制,为微血管和组织纤维化疾病研究提供了新的平台工具和新思路。

首先,该研究发现在体外普通培养皿硬基底表面长期培养的微血管周细胞(表达NG2)分化为肌成纤维细胞(表达αSMA),而且此分化过程并不受TGFβ信号通路抑制剂A83-01影响,表明存在其他信号通路参与调控周细胞命运。
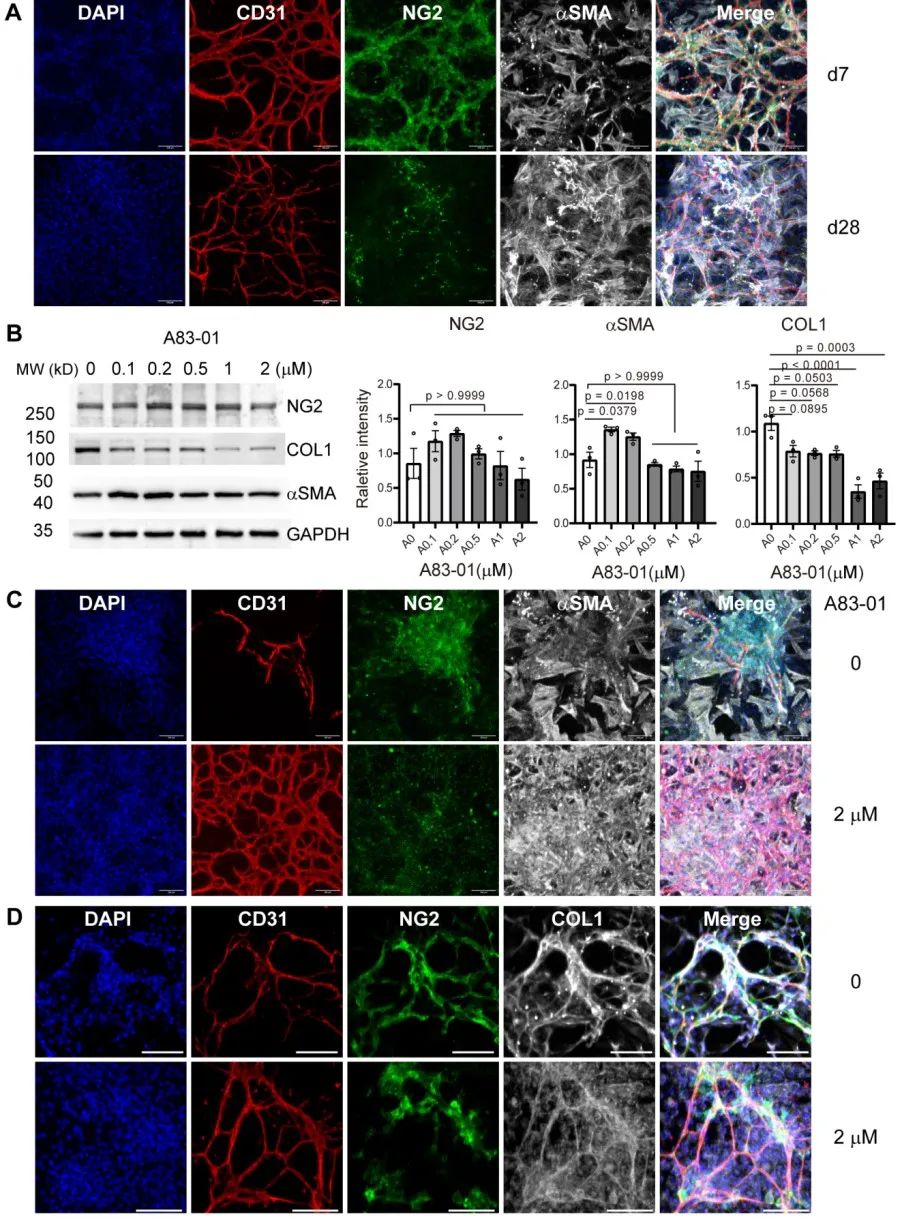
为了模拟体内细胞微环境,该研究建立了一种新型软基底模型,通过在培养皿表面沉积不同量胞外基质(ECM/extracellular matrix)蛋白从而获得不同杨氏模量(Young’s Modulus)的基底,可以更好的模拟纤维化过程中的组织硬度。相比传统的聚合物方法,该方法利用天然胞外基质蛋白,无需额外修饰蛋白或短肽以辅助细胞贴壁。利用该模型,研究者发现,在杨氏模量较小的ECM软基底上(约6kPa),TGFβ信号通路抑制剂A83-01显著抑制周细胞分化。
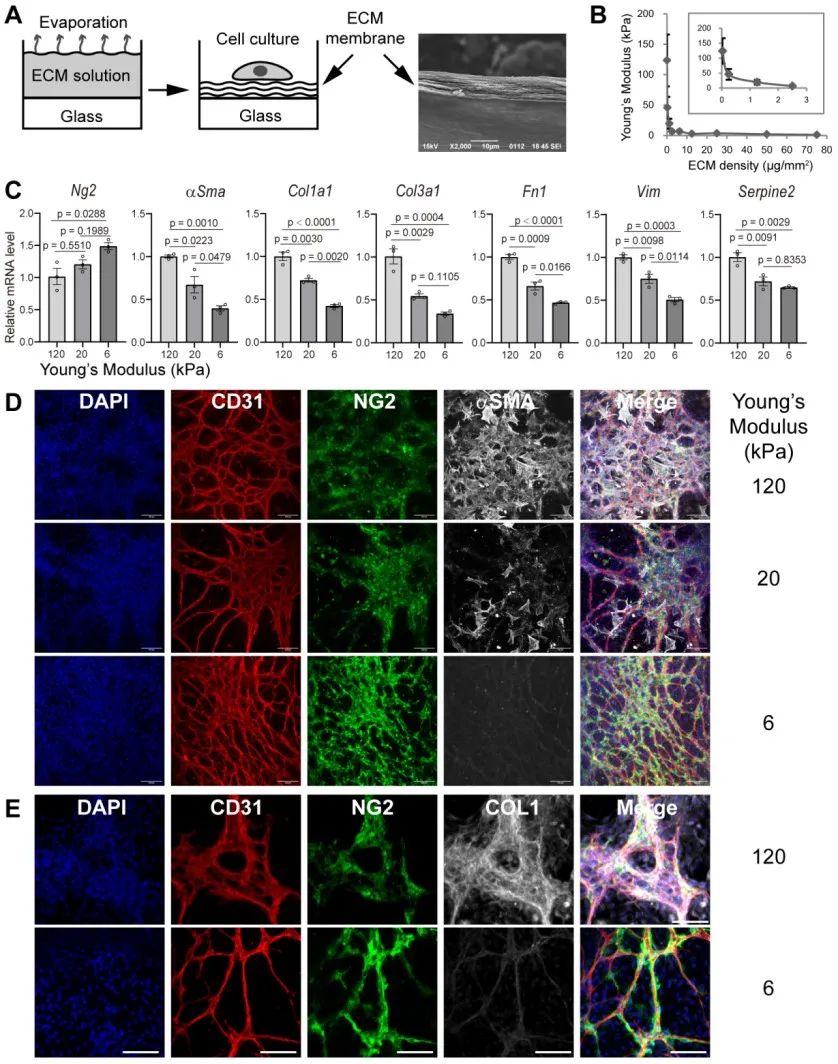
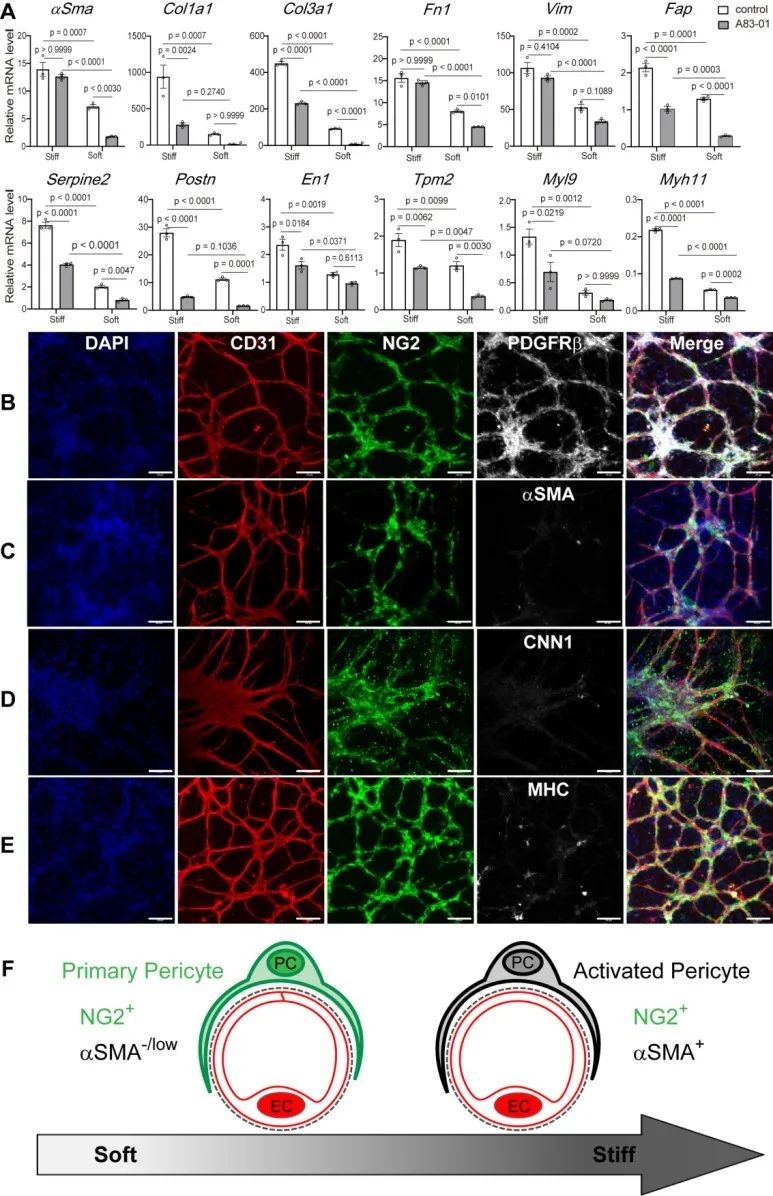
ECM软基底和A83-01协同作用显著抑制一系列纤维化相关基因表达,以及平滑肌细胞基因表达,但是仍保留周细胞特异标志物(NG2和PDGFRβ)。在以往的周细胞研究文献中,αSMA常用来作为周细胞的一个特异标志物,该研究表明微血管周细胞至少包含两个亚群:原始周细胞(primary pericyte)和活化周细胞(activated pericyte),只有激活分化的周细胞才表达αSMA。
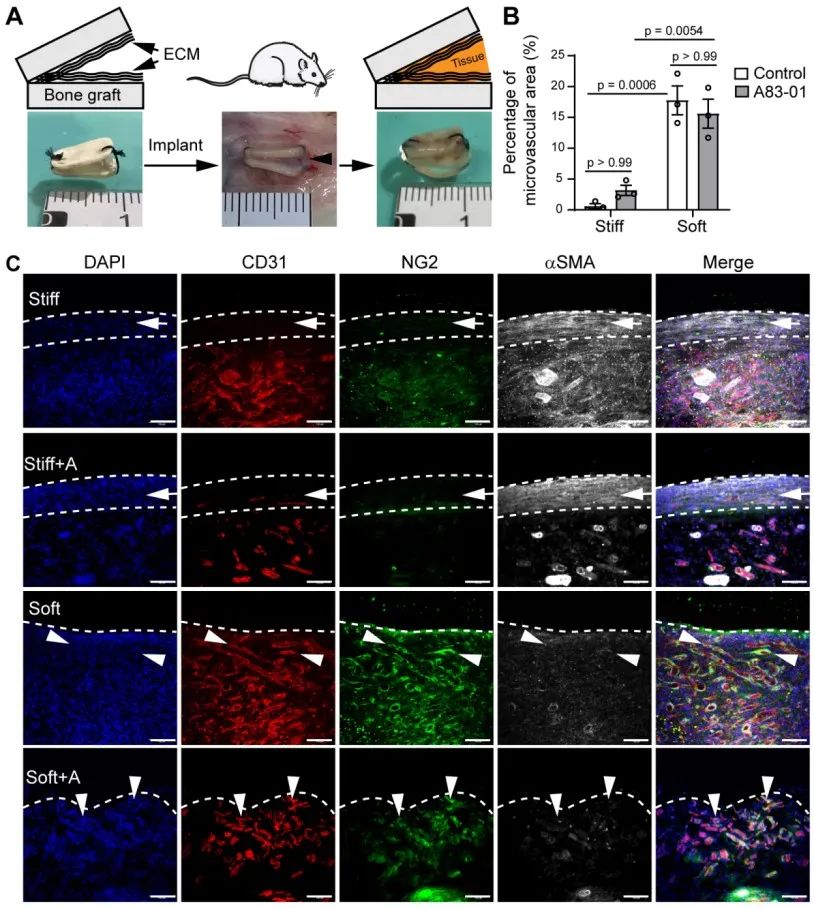
该研究进一步验证在动物体内是否存在同样的调控机制,研究者构建了大鼠同种异体骨片移植模型,发现ECM软基底修饰的骨片表面可以显著促进微血管再生,而硬的骨片表面被一层厚的纤维化组织包裹。
Integrin是介导细胞感受微环境的主要力学感受器,为了探寻软硬基底对微血管及其周细胞的调控机理,研究者利用转录组学测序和qPCR分析了Integrin家族蛋白,发现Integrin β1起主要作用,而且免疫荧光分析发现Integrin β1的磷酸化信号主要定位于微血管内皮细胞,意味着胞外基质软硬度可能通过调控内皮细胞从而诱导周细胞分化。
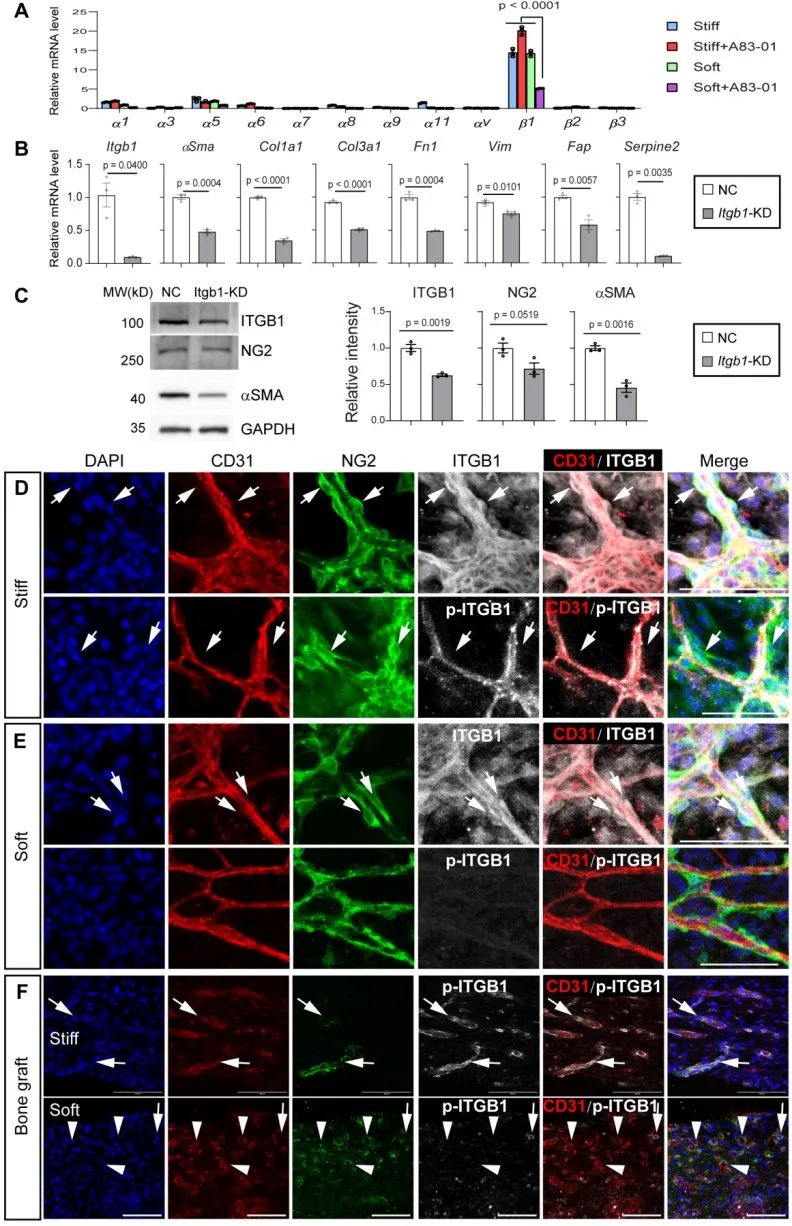
内皮细胞通过分泌多种细胞因子调控周围的组织动态,研究者发现CTGF是软硬基底通过Integrin β1调控内皮细胞的主要下游分泌蛋白。已有一些研究报道CTGF促进组织纤维化,靶向CTGF的单克隆抗体正在临床试验当中。该研究发现,CTGF敲低或单克隆抗体处理并不能完全抑制所有纤维化相关基因表达,表明可能存在其他信号通路,有待进一步研究。
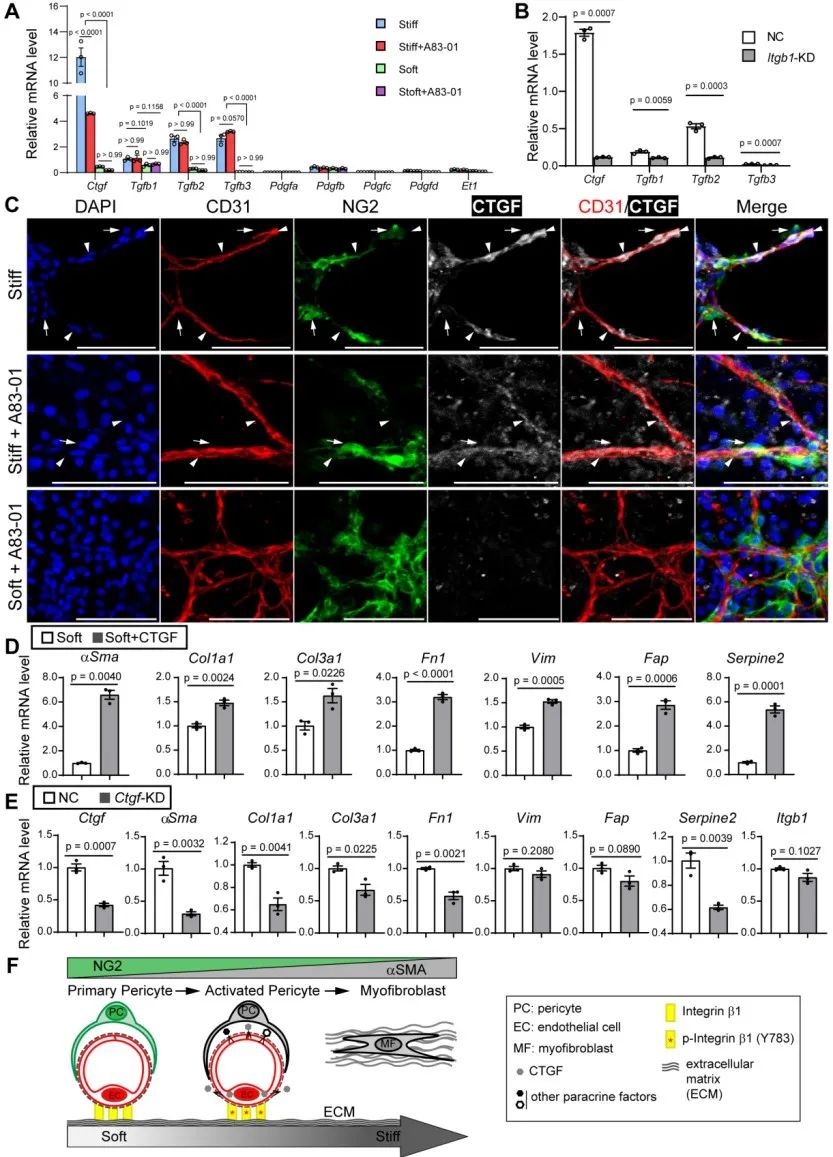
综上所述,本研究建立了一个新型微血管研究模型,发现胞外基质软硬度通过调控微血管内皮细胞Integrin β1磷酸化从而调控其旁分泌信号通路,进而诱导周细胞分化为肌成纤维细胞,导致组织纤维化。本研究也为血管再生、组织血管化和体外血管器官芯片的构建提供了新思路。
青岛大学医学部转化医学研究院王栋、李菁、青岛市市立医院祝海为本论文共同通讯作者,青岛大学医学部转化医学研究院/基础医学院2020级硕士研究生于亚丽和冷宇为共同第一作者。前期研究工作(Journal of Tissue Engineering, 2022)第一作者为2019级硕士研究生宋秀玥。本研究得到国家自然科学基金、山东省自然基金及肿瘤防治联合基金、青岛市科技局基金支持。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/ATVBAHA.123.319119


