磁共振引导放射治疗在脑转移瘤中的应用
时间:2023-04-12 20:50:50 热度:37.1℃ 作者:网络
脑转移瘤是常见的继发性恶性肿瘤,放射治疗是重要的局部治疗手段。但由于锥形线束CT(CBCT)等图像引导技术无法较好地实时显示颅内肿瘤体积、形状及瘤周水肿变化.影响了自适应放疗的精准性,限制了大剂量低分次放疗在脑转移瘤中的应用。磁共振(MR)图像具有较高的空间分辨率和软组织对比度,且无额外辐射损伤,较CBCT具有明显优势。MR引导的自适应放疗可以实时影像跟踪治疗过程中颅内肿瘤解剖形变及位置变动,并据此进行在线剂量重建,从而保证肿瘤组织得到足量照射、减少周围重要危及器官受量,达到动态的精准放疗。本文就MR引导自适应放疗在脑转移瘤中的应用进行了整理分析!

MR在脑转移瘤中的应用优势
MR无损伤、无辐射,图像软组织分辨率高,可多方位、多序列成像,且无骨性伪影,对于脑转移瘤的诊断及病变大小、数量、边界及侵犯结构的判断至关重要,是脑转移瘤首选的成像方式。因MR 对微小转移灶诊断的敏感性,使得许多无症状患者被早期发现,增加了治愈的可能性。然而,大多患者就诊时已出现神经系统症状。对于临床诊断有脑转移可能的患者,需及时完善系统性神经查体及MR为主的影像学检查。
脑转移瘤增长速度快,且周围常伴水肿带,在放疗期间因水肿消退、治疗反应等导致肿瘤几何形状、位置较治疗前出现较大改变。Hessen等研究发现,脑转移瘤接受大分割放疗时,疗中计划靶区(planning target volume,PTV)剂量覆盖率较疗前下降34.8%(平均值为3.2%),PTV接受的最低处方剂量减少2.7Gy(范围为16.5~2.3Gy),放疗期间再次行MR检查有助于优化剂量分布,提高放疗精准性。
MR-gART可于每次治疗前获取T1、T2加权及其他多功能序列图像,实时反馈治疗效果及放疗反应,并据此实时调整靶区范围,极大提高了照射野与靶病灶的吻合度,实现更有效的颅内病变控制。

脑转移瘤的放疗分割模式对治疗的影响
对于脑肿瘤的治疗,立体定向放射外科治疗(stereotactic radiosurgery,SRS)是重要手段,多项研究结果显示SRS/SRT可实现在脑肿瘤较好的局部控制基础上,显著减少神经认知不良反应。因此,1-4个脑转移灶且一般状态良好的脑转移瘤患者,推荐SRS/SRT。此外一项Ⅲ期随机对照研究结果显示,即使脑转移病灶数目较多(≤10个病灶)的患者也可通过SRS获益,且与寡转移相比疗效并无差异。
但对于难治性脑转移瘤,例如转移灶体积大(脑转移灶最长径≥3cm或体积≥6cm3)、邻近重要结构(如脑干、视通路等)、全脑放疗后多发转移(≥3个)等,单次大剂量照射耐受性较差,应用常规的SRS技术治疗后局部控制率低,瘤周水肿明显,治疗安全性较差。临床上通过分次立体定向放射治疗(fractionated stereotactic radiotherapy,FSRT)降低单次照射剂量、增加放疗次数,在保证局部控制的同时显著降低严重不良反应(如放射性脑坏死)的发生风险。然而这对于放疗的精准性提出了更高的要求,尤其对于治疗分次间可能出现较大形变的脑转移灶,实时追踪病灶状态十分必要。

MR-gART在脑转移瘤治疗中的研究
早期Yan和Georg提出自适应放疗(adaptive radiotherapy,ART)的概念,即以患者治疗期间的病灶变化、周围组织反应作为反馈结果,据此在治疗前及治疗中对靶区范围及治疗计划作出相应调整。
国内外关于MR-gART治疗脑转移瘤的报道较少,且多为探索其在临床应用中的剂量学可行性。Tseng等的研究纳入24例单发脑转移瘤患者,入组患者PTV平均体积为10.05 cm3(范围为0.13~63.05cm3),其中62.5%的患者接受18~21 Gy的单次SRS,32.5%接受24 Gy分3次的SRS,所有病例均完成容积调强弧形治疗(volumetric modulated arc therapy,VMAT)、无磁场的调强放疗(intensity modulated radiotherapy,IMRT)及基于1.5T磁场的IMRT计划设计,结果显示三种放疗计划的靶区覆盖率及OAR受量均符合临床标准,且MR磁场对X射线剂量分布干扰较小,不影响靶区适形性。Slagowski等的研究旨在对比脑转移瘤于0.35 TMR直线加速器及常规直线加速器接受SRS治疗的相关剂量学参数,其放疗计划设计基于靶病灶长径自0.6cm逐步递增为2.5cm的头部模体,结果显示两类计划适形性指数(conformity index,CI)无差异。考虑到脑组织VRe与放射性脑坏死发生的相关性,此项研究进一步分析了靶病灶大小对两类计划适形性的影响,结论为:若脑转移瘤最长径≤2.25cm,两种放疗计划Cl无差异,且均满足正常脑组织V12 Gy ≤10cm3的计划要求;对于最长径>2.25cm的脑转移瘤来说,常规直线加速器的非共面计划更优。Slagowski 等随后选取6例既往已于常规加速器接受SRS的脑转移患者,靶病灶最长径为0.7~1.9cm,重新评估基于0.35TMR 引导的直线加速器完成SRS的剂量学可行性,结果显示放疗计划Cl为1.12~1.65,脑组织V12 Gy≤6cm³,计划γ通过率>97.6%,6例患者治疗计划均满足临床治疗要求,因此作者认为若脑转移瘤最长径52.25cm,接受MR引导SRS是可行的。虽然MR-gART治疗脑转移瘤的相关研究有限,但已报道数据显示出其在临床应用中的巨大潜力。此外,MR引导的大分割放疗在胶质瘤、前列腺癌、肝癌、肺癌中的应用均有报道,治疗可行性得到认可。MR-gART的广泛临床应用值得期待。

MR-gART在脑转移瘤治疗中的实际临床应用
目前用于临床的MR直线加速器有ViewRay公司设计的MR引导60Co治疗机(MRIdian system)、MR引导的直线加速器,以及Elekta公司的Unity系统。Elekta Unity系统作为国际首批MR直线加速器,由1.5T大孔径MR成像引导的7MV加速器调强放疗系统,支持同步MR影像采集和治疗,从而实现MR引导的自适应放疗。现国内拥有MR加速器的单位仍为少数,应用其治疗脑转移瘤的经验尚不足。
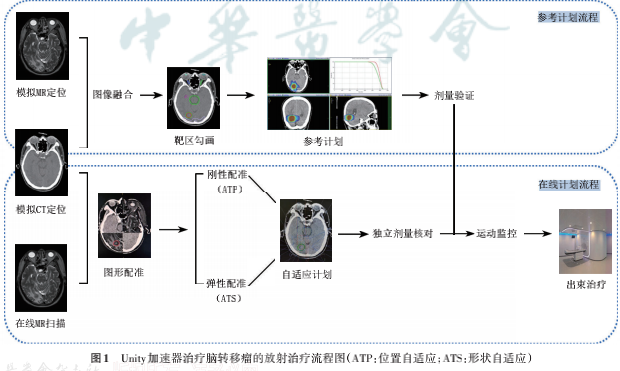
图1展示了应用Unity治疗脑转移瘤的治疗流程。
放疗前准备包括摆位、体位固定、CT模拟定位及MR模拟定位、图像融合、靶区勾画等,与常规加速器治疗前准备相同。Elekta Unity系统配合使用Monaco治疗计划系统,完成疗前参考计划设计。Monaco支持基于图形处理器(graphic processing unit,GPU)的蒙特卡罗算法,可精确计算在1.5T 磁场下的剂量分布,也可快速完成在线计划的计算。患者于每次治疗前均在线采集三维MR扫描图像,考虑T2加权序列对脑转移病灶显示更佳,因此优选T2加权图像。扫描完成后,在Monaco系统进行在线影像与参考影像的刚性或弹性配准。若配准误差小、靶区及0ARs形变小,执行位置自适应(adapt to position,ATP)流程,不对解剖轮廓进行修改,可基于参考CT对多叶光栅子野、子野权重优化,或对子野权重形状同步优化,而不改变优化参数和条件。若配准误差大、形变不可接受,则执行形状自适应(adapt to shape,ATS)流程。ATS支持手动修改靶区及OARs,并根据参考CT影像的相对电子密度赋值于当次MR影像,生成合成CT (synthetic CT,sCT),基于sCT完成剂量评估和计划优化。治疗计划由医师和物理师共同在线审核后执行。
参考文献
[1] Mehta MP,Rodrigus P,Terhaard CH,et al.Survival and neurologic outcomes in a randomized trial of motexafin gadolinium and whole-brain radiation therapy in brain metastases[J].] Clin Oncol,2003,21(13]:2529-2536.DOl:10.1200/JC0.2003.12.122.
[2] Meyers CA,Smith JA,Bezjak A,et al.Neurocognitive function and progression in patients with brain metastases treated with whole-brain radiation and motexafin gadolinium: results of a randomized phase Ill trial[J].J Clin Oncol,2004,22(1):157-165.DOI:10.1200/JC0.2004.05.128.
[3] Garcla MA, Anwar M,Yu Y, et al. Brain metastasis growth on preradiosurgical magnetic resonance imaging[J].Pract Radiat Oncol,2018,8(6):e369-e376.DOl:10.1016/j. prro.2018.06.004.
[4] Salkeld AL, Hau E, Nahar N, et al. Changes in brain metastasis during radiosurgical planning[J]. Int J Radiat Oncol Biol Phys,2018,102(4):727-733.DOl:10.1016/j. ijrobp.2018.06.021.
[5] Hessen E,Nijkamp ],Damen P,et al.Predicting and implications of target volume changes of brain metastases during fractionated stereotactic radiosurgery [J].Radiother Oncol,2020,142:175-179.D0I:10.1016/j. radonc.2019.07.011.
[6] Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial[J]. JAMA, 2006,295(21):2483-2491.DOI:10.1001/jama.295.21. 2483.
[7] Chang EL,Wefel JS,Hess KR,et al.Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial[J]. Lancet Oncol,2009,10(11):1037-1044.DOl:10.1016/S1470-2045(09)70263-3.
Brown PD, Jaeckle K, Ballman KV, et al. Effect of [16]
radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases: a randomized clinical trial[]]. JAMA, 2016, 316(4): 401-409. DOI: 10.1001/jama.2016.9839. Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic
[8] radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study[J]. Lancet Oncol, 2014, 15(4):387-395.D0l:10.1016/S1470-2045[14]70061-0.
[9] Lehrer E],Peterson JL,Zaorsky NG,et al.Single versus multifraction stereotactic radiosurgery for large brain metastases:an international meta-analysis of 24 trials[]]. Int ]Radiat Oncol Biol Phys,2019,103(3):618-630.DOI:10.1016/j.ijrobp.2018.10.038.
[10] Gutschenritter T,Venur VA,Combs SE,et al.The judicious use of stereotactic radiosurgery and hypofractionated stereotactic radiotherapy in the management of large brain metastases[J].Cancers(Basel),2020,13(1]:70.DOl:10.3390/cancers13010070.
[11] Jiang XS, Xiao JP, Zhang Y, et al. Hypofractionated stereotactic radiotherapy for brain metastases larger than three centimeters[J]. Radiat Oncol,2012,7:36. DOI:10.1186/1748-717X-7-36.
[12] Bi N,Ma Y,Xiao J,et al.A phase Il trial of concurrent temozolomide and hypofractionated stereotactic
肿瘤课程交流群

本文观点仅代表作者本人,仅供学习交流
本文来源:中华放射肿瘤学杂志2023年1月
授权转载/合作/投稿/直播请联系「锐博士」
-
结直肠癌癌前病变常见疑问汇总!
-
全面解析!直肠癌术前/术后适形调强放疗靶区勾画共识!
-
【指南与共识】2022 CSCO宫颈癌诊疗指南
-
智能勾画功能| 放疗医师”云办公”神器—Aiteam放疗云平台
-
投稿指南|放疗前沿诚邀您投稿!


