Nature子刊:再取进展!同济大学陈义汉/梁丹丹发现心室腔发育调控新机制
时间:2023-04-12 20:38:14 热度:37.1℃ 作者:网络
心室腔的生长和成熟需要不同细胞类型之间的时空精确协同作用。选择性剪接深深影响了这些过程。然而,心脏发育中选择性剪接的功能特性在很大程度上是未知的。
2023年3月31日,同济大学陈义汉及梁丹丹共同通讯在Nature Communications 发表题为“Endothelial deletion of PTBP1 disrupts ventricular chamber development”的研究论文,该研究表明一种选择性剪接因子多聚嘧啶区结合蛋白1(PTBP1)在心室腔形态发生中起关键作用。在心脏发育过程中,PTBP1与内皮细胞共定位,但在心肌细胞中几乎检测不到。在心内膜细胞或泛内皮细胞中,PTBP1的内皮特异性敲除导致左心室致密化不全(LVNC)的典型表型。
从机制上讲,PTBP1的缺失减少了内皮细胞的迁移,破坏了心肌细胞增殖,最终导致LVNC。进一步的研究表明,PTBP1缺乏改变了β-抑制蛋白-1(Arrb1)的选择性剪接,从而影响内皮细胞迁移。综上所述,PTBP1作为选择性剪接因子,在心室腔发育过程中是必不可少的,其缺乏可导致先天性心脏病。
另外,2022年8月2日,同济大学陈义汉团队在Cell Discovery在线发表题为“Memantine targets glutamate receptors in atrial cardiomyocytes to prevent and treat atrial fibrillation”的研究论文,该研究发现美金刚可通过阻断心房心肌细胞内源性iGluRs有效预防和终止房颤,为临床治疗房颤提供了新的策略。该研究首次展示了美金刚对动物 AF 模型的有益作用。
2022年7月8日,同济大学陈义汉、张奇及中国医学科学院心脏节律起源与调控研究团队李丽共同通讯在Nature Communications在线发表题为“CDC-like kinase 4 deficiency contributes to pathological cardiac hypertrophy by modulating NEXN phosphorylation”的研究论文,该研究报告了一项CDC样激酶4(CLK4)通过NEXN磷酸化途径调节心功能的机制研究,研究表明CLK4是心肌细胞肥大和心力衰竭的关键调节因子。因此,可认为CLK4通过NEXN磷酸化途径调节心功能,其缺乏可能导致病理性心肌肥厚。CLK4也可作为预防和治疗心衰的潜在干预靶点。
2022年7月15日,同济大学陈义汉团队在Cell Research在线发表题为“Glutamate drives ‘local Ca2+ release’ in cardiac pacemaker cells”的研究论文,该研究报告内源性谷氨酸驱动 SANPCs 中的 LCR。使用谷氨酸感应器,该研究揭示了谷氨酸积累和 LCR 发生之间的紧密相关性,表明谷氨酸和 LCR 之间存在潜在关系。总之,该研究结果表明,谷氨酸在 SANPCs 中充当 LCR 点火器,为解释自发点火起源的耦合时钟理论增加了一个潜在的重要元素。这些发现为未来预防和治疗心脏起搏器细胞相关的心律失常提供了新的思路。

在哺乳动物心脏发育过程中,心肌小梁的压实对心室腔形态发生至关重要。在发育早期阶段,小梁的形成有助于氧气的吸收和营养供应。随着发育的进行,小梁的这种功能逐渐退化,取而代之的是冠状血管。然后,大部分小梁进行压实,有助于形成成熟的心室。小梁致密化缺陷通常表现为左心室肌致密闭不全(LVNC),其特征是心肌小梁过度生长、心肌致密薄和深小梁间凹陷。作为继扩张型和肥厚型心肌病之后第三大常见心肌病,LVNC越来越被认为是全身性栓塞、恶性心律失常、心力衰竭和猝死的重要病因。
心室小梁化和致密化压实是由不同细胞类型之间的相互作用控制的动态过程。内皮细胞和心肌细胞的精确协调已被证明对心室生长和小梁形成至关重要。包括Notch和Neuregulin信号传导在内的几种途径已被确定为这些过程的关键调节因子,并且与LVNC的发病机制密切相关。然而,在心室发育过程中控制正常小梁和致密化方面仍然缺乏足够的知识。阐明潜在机制仍然是心脏发育领域的一个挑战。选择性剪接是一种重要的转录后调控,对各种生物过程至关重要。作为选择性剪接因子,多聚嘧啶区结合蛋白1(PTBP1)控制许多选择性剪接事件。据报道,Ptbp1中的纯合突变严重影响胚胎干细胞的增殖,导致早期发育阶段的胚胎致死性。
该研究揭示了PTBP1在心室腔发育过程中与内皮细胞的特征性共定位。Ptbp1的内皮特异性敲除通过调节内皮细胞的迁移和心肌细胞的增殖导致LVNC。在Ptbp1缺陷的内皮细胞中观察到两种ARRB1亚型表达比之间的切换变化,并显示影响内皮细胞迁移。此外,由Ptbp1缺乏引起的剪接事件和基因表达改变涉及与心脏发育缺陷(包括LVNC)密切相关的生物过程和信号通路。
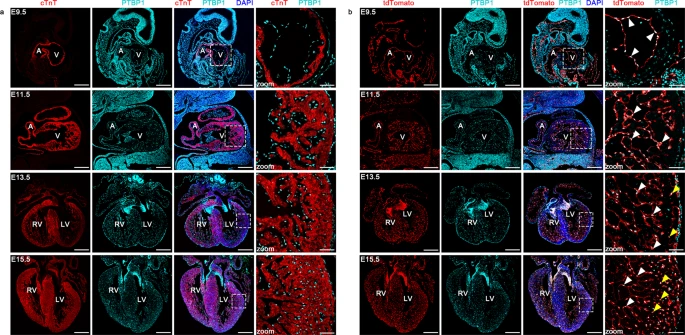
PTBP1在心脏发育过程中与内皮细胞的共定位(图源自Nature Communications )
综上所述,该研究证明了PTBP1作为剪接因子在LVNC发病机制中的重要作用。内皮细胞中Ptbp1的特异性敲除导致内皮细胞迁移和心肌细胞增殖的破坏,从而影响心室腔发育。该研究还观察到,Ptbp1缺乏影响了其他心脏病理过程中涉及的多种信号通路,从而提供了对PTBP1和心脏病的见解。此外,研究数据表明胚胎阶段不同细胞类型的时空相互作用缺陷是器官发育障碍的潜在重要机制。
参考消息:
https://doi.org/10.1038/s41467-023-37409-9


