最新!探讨早发性卵巢功能不全的治疗研究进展!
时间:2023-08-13 11:33:58 热度:37.1℃ 作者:网络
卵巢功能会随着年龄的增加而不断减退,部分女性在40岁前便提前发生卵巢功能减退。早发性卵巢功能不全(POI)指女性40岁之前因卵泡数量耗竭或残存卵泡质量不佳而致使卵巢功能丧失,已成为女性卵巢功能下降的重要因素。
POI主要临床表现为:停经或月经稀发至少4个月;卵泡刺激素(FSH)水平>25 U/L;间隔4周测定两次雌激素水平波动性下降伴低雌激素、促性腺激素升高等。POI除月经紊乱及因内分泌失调所带来的一系列激素不足所致的临床症状外,部分女性还因不孕就诊,是女性不孕症的重要病因之一。
虽然POI的病因尚未明确,目前研究认为可能与遗传、医源、环境、免疫等因素相关。近年来,POI分子机制的研究不断深入,抗氧化剂治疗、线粒体疗法、干细胞疗法等新兴医疗被不断提出,有望为POI治疗提供新的理论依据和方向。
因此,本文旨在以POI相关的信号转导通路为基础,从分子机制层面对POI治疗新进展做一综述,归纳相关临床治疗的应用实例及前景,为恢复患者卵巢功能、寻找潜在的药物治疗靶点和新的诊疗技术提供新思路。
一、POI相关信号通路
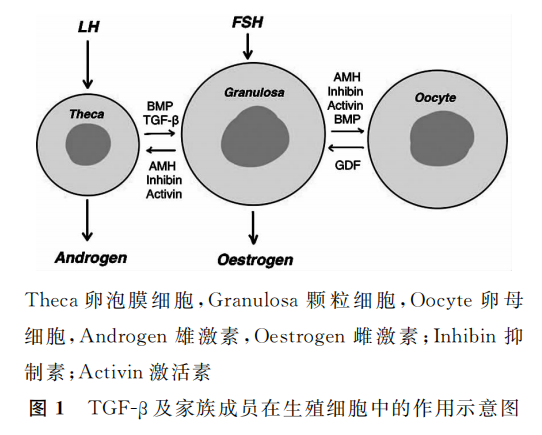
1.转化生长因子β(TGF-β)及其家族成员信号通路:TGF-β在卵巢颗粒细胞和间质细胞中表达,在生殖细胞的增殖分化和胚胎形成中发挥重要作用(图1)。
其中,TGF-β1能增强颗粒细胞分化以及黄体生成素(LH)受体蛋白表达,调控下游转录因子磷酸化,影响雌、孕激素合成,促进细胞凋亡和卵泡闭锁;其他亚家族成员如骨形态发生蛋白(BMP)、生长分化因子(GDF)、激活素、抑制素以及抗苗勒管激素(AMH)等也与POI有很强的的相关性。
BMP被认为可以通过磷酸化途径调节卵泡发育,通过旁分泌或自分泌途径影响颗粒细胞间缝隙连接的形成,减少细胞间的交流,最终影响胚胎发育、卵泡分化、卵母细胞的产生和正常受精。
GDF-9与POI的关系密切,其mRNA仅在卵巢中高水平表达,调控卵母细胞的发育成熟和卵丘膨胀,可以与BMP-15形成异源二聚体来,在分子和功能水平上协同调控卵巢功能。
此外,其他家族成员如激活素、抑制素和AMH等,在调控胚胎发育和卵巢功能方面发挥多种作用。TGF-β超家族介导的信号途径与POI的发展密切相关,进一步探讨相关机制有助于为POI提供治疗依据和靶点。
(图1)
2.磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B (AKT) 信号通路:PI3K-AKT信号通路作为体内的基础信号通路,参与细胞生长、增殖、分化及凋亡。
AKT是PI3K信号通路的下游靶激酶,被激活后磷酸化下游的蛋白;与POI相关性较强的为叉头转录因子O3 (FoxO3)和雷帕霉素靶蛋白(mTOR)参与构成的通路。
FoxO3主要起抗增殖及凋亡的作用,是PI3K下游信号通路中的重要转录因子,其位于细胞核中,能使原始卵泡维持静息状态,能够维持原始卵泡池休眠与激活的平衡。FoxO3的转录调控主要受PI3K-AKT途径的磷酸化调节,这一观点早在1999年就由Brunet等提出。特异性消除卵母细胞中的负性调控因子——磷酸酯酶与张力蛋白同源物,会导致AKT过度活化、FOXO3过度磷酸化并从胞核转移到胞质,导致原始卵泡池过度激活,最终导致卵泡消耗与POI的发生。
FoxO3信号通路能诱导卵母细胞凋亡、抑制原始卵泡的激活,保持原始卵泡初始状态和调节卵泡的生长发育进程,该通路负性调控会导致卵泡激活延迟和原始卵泡闭锁;相关氧化蛋白可以通过激活此通路调节卵泡生长。
mTOR信号通路调控蛋白生物合成和控制细胞生长与增殖,其接受各种细胞内、外的信号刺激,并与其他信号刺激协同作用,调节休眠的原始卵泡。mTOR受体阻滞剂可抑制原始卵泡激活,并保存生育能力。
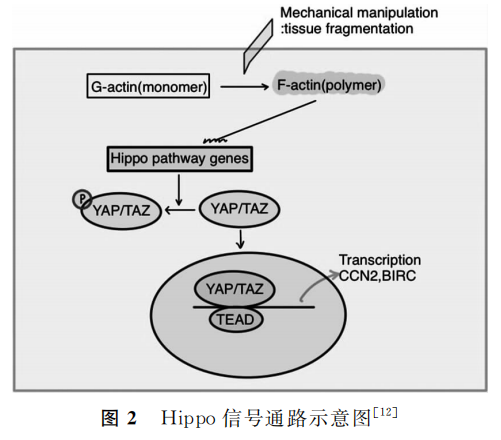
3. Hippo信号通路:Hippo信号通路可以抑制细胞生长,其基因缺陷与多囊卵巢综合征、卵泡储备功能降低以及卵巢上皮细胞肿瘤的发生密切相关。Hippo信号通路相关分子可通过调控卵巢生殖干细胞的增殖来参与调节卵巢功能。
Kawamura等发现,将卵巢组织切割成碎块的机械操作,可通过抑制Hippo信号传导、增加下游生长因子的表达来激活卵泡,以促进卵泡生长和成熟卵母细胞的产生(图2)。除了卵泡激活外,目前对POI中Hippo信号通路的了解相对较少,需要进一步研究。
(图2)
二、基于信号通路对POI的治疗手段
(一)抗氧化剂相关治疗
在卵巢功能减退期间,卵巢中的活性氧(ROS)和炎性因子水平显著升高。由各种因素诱发的氧化应激可以激活细胞内PI3K/AKT途径,基于这一机制减少氧化应激损伤的用药,可以是直接抗氧化剂,也可以是影响卵巢细胞内抗氧化信号通路的分子。
1.褪黑素(MT):MT是由脑松果体腺细胞合成及分泌的激素,属吲哚杂环类化合物,可以直接从生物膜进入细胞,清除活性氧自由基、减少氧化应激损伤,也可以与特异性受体MT1、MT2结合,激活不同的细胞分子信号通路,调节细胞功能。其明显的抗氧化效应可以用于防治各种原因所致的氧化应激损伤,保护线粒体蛋白和DNA。同时,MT作为一种内源性分子,还可以直接抑制卵泡激活、生长和闭锁,从而减缓卵巢衰老。MT有强大的神经内分泌免疫调节活性和直接清除活性氧自由基的能力,是最具代表性的抗氧化剂。
多项研究表明,MT超强的抗氧化作用可保护化疗源性卵巢损害。MT通过抑制由于顺铂诱发激活的PI3K/AKT/FOXO3a通路,增强FOXO3a介导的抗氧化效应,预防顺铂导致的原始卵泡过度激活,减少原始卵泡的损失,从而保护和稳定卵巢池储备。
MT还可通过Hippo途径参与抑制卵泡激活和生长,并通过MT1/AMPK途径参与增加卵母细胞的数量、改善其质量及受精和分裂过程,提高生育力。研究显示,在对198例多囊卵巢综合征患者应用双盲随机对照实验进行宫腔内人工授精,结果表明MT(3 mg/ml)治疗能改善卵泡质量,显著提高妊娠率。
2.生长激素(GH):GH是由脑垂体前叶分泌的一种肽类激素,被认为在人体生长和发育中起着关键性作用,能够促进生长、促进蛋白质和核酸的合成以及脂肪和糖的降解。
GH不是直接的抗氧化剂,但会对细胞的氧化应激造成影响,参与干预细胞防御氧化应激的细胞信号通路。GH被认为能诱导小鼠体内抗氧化酶的表达,扭转因高龄等因素导致的抗氧化酶水平下降的趋势,减弱细胞线粒体DNA损伤,发挥间接抗氧化作用。
成人缺乏GH会导致细胞对自由基产生的敏感性反应性降低,这与年龄因素或其他原因造成的GH缺乏所致卵巢功能衰退相关联。相关研究证实了GH对于女性生殖系统的积极作用:GH能够减轻卵泡液的的氧化应激,改善颗粒细胞中线粒体的功能和卵母细胞质量;此外,外源性GH给予反复胚胎移植失败的女性,其IVF结局的改善与卵母细胞发育潜能的提高有关。
因此,GH可作为POI患者的的辅助疗法,通过其生理特性和参与调控细胞抗氧化活性的信号途径来改善卵巢功能。
对11项随机对照研究的Meta分析发现,补充GH显著提高了扳机日血清雌二醇水平及获卵数、MII期卵母细胞数,临床妊娠率和活产率得到明显改善,并显著降低了周期取消率和促性腺激素(Gn)用量。
研究表明,在卵泡发育的初始阶段进行GH预处理,其敏感性强,能够增加卵泡募集,提高卵母细胞质量,但GH用法用量及最佳添加时机尚未达成共识。
在体外受精-胚胎移植(IVF-ET)周期中,临床上HCG给药前4~6周给予GH(4~6 U/d)的方案被广泛接受,专家建议在促排卵周期之前3个月开始,即从窦前卵泡开始,GH参与调控卵泡发育,直至卵泡发育成熟排卵,其通常与促排卵药物联合使用;POI患者IVF-ET中的应用GH能够改善卵巢储备功能,提高卵巢反应性,提高卵母细胞质量,增加获卵数、可用胚胎数、优质胚胎数,提高胚胎质量及妊娠率,改善妊娠结局。
然而,过量使用GH会导致糖代谢紊乱和胰岛素代谢异常,长期使用可能会增加糖尿病等疾病的风险。GH添加的最佳方案仍需要更进一步的基础研究和更大样本量的临床研究来证实。
3.直接抗氧化剂:包括多种制剂,常用者如辅酶Q10(CoQ10)、白藜芦醇(RSV)、维生素E(VE)等。
CoQ10在线粒体内膜上参与电子传递和ATP生成,具有促进抗氧化、延缓衰老和增强免疫的作用。CoQ10可以抑制因化疗药物导致的DNA氧化损伤的生物标记物——8-羟基脱氧鸟苷(8-OHDG)表达增加所致的氧化应激损伤。卵母细胞质量与线粒体功能密切相关,CoQ10通过调节线粒体的功能,来改善卵细胞的质量和受精能力以及胚胎发育的质量。CoQ10可以激活线粒体内的MnSOD活性,抑制氧化应激,可以通过作用于氧化呼吸链,清除体内和细胞中的自由基,改善卵母细胞线粒体的功能。
研究表明,在IVF周期外源性补充CoQ10,对于辅助助孕过程中患者的卵巢反应性、获卵数、受精率及胚胎质量,以及胚胎整倍体率等均有积极的作用,进而改善妊娠结局。此外,CoQ10与其他辅助生殖预处理联合应用可有一定的改善趋势,如CoQ10联合DHEA、CoQ10联合维生素E等均可在一定程度上改善卵巢储备低下患者的卵巢反应性,联合使用CoQ10和维生素E可以有效改善高龄女性卵巢的抗氧化保护作用,改善卵巢储备,相比于单一应用效果更佳。
目前对于CoQ10的用药剂量及持续时间尚缺乏前瞻性的临床支持,常见的补充方案为600 mg/d,连续60 d,但长期的预治疗可能使患者医从性变差。因此,补充CoQ10的最佳剂量和时机仍在探索阶段。
白藜芦醇(RSV)是一种来自葡萄的强效抗氧化剂,具有抗肿瘤、抗炎、抗氧化和抗衰老特性。它通过抑制脂质过氧化、清除自由基和调节抗氧化相关酶的活性来发挥抗氧化作用。通过激活PI3K/AKT/mTOR途径,RSV能有效减少细胞氧化的应激,减少颗粒细胞和卵母细胞的凋亡,调控卵巢发育。
研究表明,添加RSV显著提高了谷胱甘肽过氧化物酶(GPx1)的表达,通过降低GPx1及抗凋亡蛋白的表达,减少卵巢组织相关的氧化应激、卵泡颗粒细胞及卵母细胞的凋亡和卵泡闭锁。此外,RSV能显著改善小鼠卵母细胞染色体排列和纺锤体形态,小鼠各级卵泡数目和卵母细胞质量可观。
维生素E(VE)是一种脂溶性抗氧化剂,其水解物生育酚具有良好的抗氧化作用,能调节体内氧化还原平衡,增强体内抗氧化酶的作用,VE与超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)一起在体内形成一个抗氧化系统。
VE缺乏会导致机体的抗氧化能力降低,机体抗氧化动态失衡,最终影响卵母细胞的质量。作为卵巢组织和卵泡液内重要的抗氧化剂,VE可以攻击清除细胞膜的活性氧自由基,保护卵母细胞,增加其数量和提高其质量,保护卵巢功能,抑制POI发生。
在卵巢功能不全的辅助治疗中使用一定量的VE可取得很好的疗效,值得在临床上推广应用。目前我国尚未直接提出VE可耐受最高摄入量,临床上常见的添加剂量为VE软胶囊100~200 mg/次,3次/d。
(二)原始卵泡体外激活(IVA)
IVA是指体外激活原始卵泡,从这些由于体内卵泡休眠或发育失调而无法自体激活始基卵泡的患者身上获得成熟的卵母细胞,是一种使卵泡生长至可接受外源刺激的阶段,结合促排卵获得成熟卵泡的新途径。IVA可通过药物或非药物手段,在体外激活PI3K/AKT信号通路、mTORC1信号通路、阻断Hippo信号通路等卵泡发育相关信号通路,诱导原始卵泡发育后,将含有原始卵泡的卵巢组织重新植入患者体内,最终实现患者的生育目的。
2013年,Kawamura等首次报道了采用IVA技术实现卵泡体外激活使1例POI患者妊娠成功并分娩,他们将POI患者的卵巢组织在体外切割成小块,破坏Hippo途径并激活Akt途径,体外激活原始卵泡后回植。郑州大学第一附属医院于2016年报道了国内首例应用IVA技术让POI患者成功妊娠并分娩。
Ferreri等对14例POI女性进行了非药物IVA,手术过程包括腹腔镜切除卵巢皮质、组织碎裂和自体移植,手术后立即开始使用人绝经期促性腺激素 (HMG),最终有7名患者检测到卵泡发育,有5名成功取卵,并获得2例活产、1例持续妊娠。这种单纯通过物理切割破坏Hippo信号通路以实现始基卵泡的激活,无药物添加的激活方式有效提高了IVA技术的安全性。此外,由于IVA采用了原位移植技术,患者也可能在没有取卵和移植等干预的情况下自然妊娠。
IVA技术不仅是一种辅助受孕策略,还能保存女性的生育力。此外,IVA技术不仅适用于育龄女性也同样适用于青春期前的女孩。IVA的效果取决于POI 患者卵巢中保留的原始卵泡数量,术前充分评估POI患者可能的原始卵泡数量是极为重要的。目前,IVA技术仍需完善,在临床成功率和安全性等方面存在问题,需要继续研究和实践。
(三)干细胞移植
干细胞是一类早期的、未分化的细胞,具有多向分化潜能及自我更新能力,是位于细胞系顶端的最原始起源的细胞,可以在体内分化形成特定的组织类型。
间充质干细胞(MSCs)具有多向分化的特性,大量研究证实不同组织来源的MSCs通过多种的信号分子通路及基因表达途径可以改善POI女性卵巢功能,表现其极强的再生、分化和修复能力。MSCs通过分泌作用减少颗粒细胞凋亡、促进颗粒细胞增殖、促进血管生成和诱导自身干细胞恢复卵泡发育等机制恢复卵巢功能。与POI关系密切的MSCs主要包括人骨髓组织来源干细胞(HBMMSCs)、胎儿附属物来源干细胞、子宫特有来源干细胞以及其他来源干细胞等。
HBMMSCs可作用于PI3K途径,激活人卵巢微血管内皮细胞(HOVEC),增加血管生成标志物的表达使内皮细胞增长和血管生成增多,促使卵泡发育和成熟,从而提高卵巢储备。Edessy等腹腔镜下将HBMMSCs定位注入10名POI患者卵巢,其中2名患者恢复了月经,1名患者成功妊娠。
相比HBMMSCs,胎儿附属物来源的MSCs更易获取,人胎盘来源的间充质干细胞(hPD-MSCs)、人羊膜间充质干细胞(HAD-MSCs)、人羊水间充质干细胞(hAF-MSCs)以及人脐带组织间充质干细胞(hUC-MSCs)都具有广泛的研究及应用前景。hPD-MSCs可通过PI3K/AKT信号通路,参与POI小鼠卵巢功能的恢复。此外,hUC-MSCs可通过调节Hippo信号通路,从而显著提高卵巢颗粒细胞的增殖能力及改善卵巢功能。卵巢和脐带间充质干细胞共同培养能促进小鼠卵巢中FOXO3a和FOXO1磷酸化,从而促进原始卵泡激活。
不同组织来源MSCs治疗POI的研究值得更深入的探讨。由于大部分机制尚未明确,干细胞的来源、分离及移植等过程缺乏临床统一,其可行性及安全性尚需更大样本的基础实验及临床研究应用来验证。
三、结语与展望
POI的致病机制需要不断探索。基于既往的研究成果,进一步研究调控卵泡生长和激活的多种相关信号通路及分子之间的相互作用,不但可以通过致病基因及作用机制推测卵巢功能在POI发病过程中的变化趋势,也有助于为高危人群的遗传和生育咨询建立理论基础,进而为POI相关治疗提供药物靶点,寻找更多高效且安全的方法为POI患者提供治疗选择,以优化临床工作中的诊治策略。
文章来源:杨曼,孟昱时.基于分子机制探讨早发性卵巢功能不全的治疗研究进展[J].生殖医学杂志,2023,32(7):1109-1115.


