AHR抑制剂IK-175在尿路上皮癌中显示潜在的活性
时间:2023-01-24 06:01:40 热度:37.1℃ 作者:网络
明星药物PD1/PD-L1抑制剂在给患者带来新的治疗选择同时,也给药物研发公司带来了丰厚的利润。当然,PD1/PD-L1抑制剂类药物也有不足之处,如普遍应答率仍不令人满意。许多公司正在寻找新的肿瘤相关的免疫调控靶点,以解决未满足的临床需求。
芳香烃受体(Aryl Hydrocarbon Receptor, AHR)最开始被认为是细胞应对异物质(xenobiotic)进行反应,促进外源毒素代谢的转录调控因子。近年来人们研究发现,AHR还在维持免疫系统平衡中起着至关重要的作用。AHR或其内源性激动剂在肿瘤微环境的过表达或异常激活的情况,而这些调控异常对肿瘤的免疫逃逸具有促进作用,因此开发相应的AHR抑制剂有望增强免疫系统对肿瘤细胞的杀伤作用。
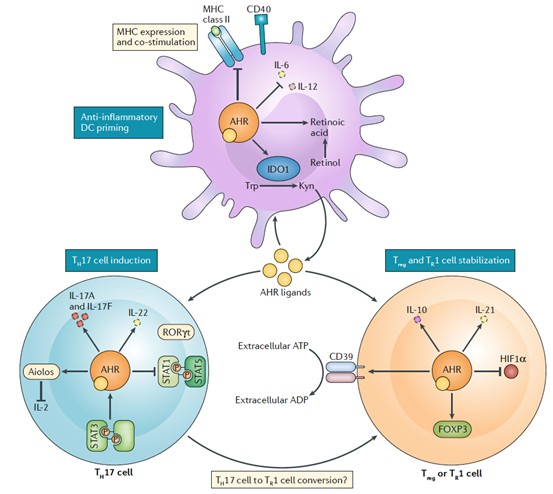
图1 AHR在维持免疫平衡中的作用。
根据来自 nivolumab (Opdivo) 的初始数据 正在进行的 1a/b 期研究 (NCT04200963)显示选择性小分子 AHR 抑制剂 IK-175 被发现在晚期实体瘤患者中具有良好的耐受性,并且在单独使用或与 nivolumab (Opdivo) 联合使用时会在尿路上皮癌患者中引起反应,[1]
图:IK-175分子结构
研究剂量递增部分的结果表明,单独接受 IK-175 治疗的 15 名患者中有 3 名,以及接受 IK-175 联合治疗的 5 名患者中有 2 名经历了 16 至 74 周的长期稳定疾病 .
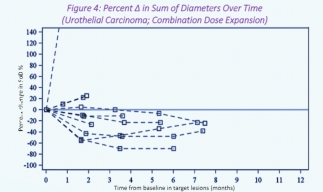
此外,在尿路上皮疾病患者 (n = 20) 的剂量扩展队列中,接受单药治疗的 1 名患者 (n = 10) 和接受联合治疗的 2 名患者 (n = 10) 实现了部分缓解。 在这些患者中,缓解持续时间 (DOR) 为 4.5 至 14.9 个月。
“据我们所知,IK-175-001 是第一个报告小分子 AHR 拮抗剂在先前检查点抑制 [CPI] 进展的尿路上皮癌患者中的数据的临床项目,”主要研究作者,医学博士 David H. Aggen 美国纽约纪念斯隆凯特琳癌症中心的博士及其同事在 2022 年 SITC 年会期间展示的数据海报中写道。
AHR 是一种配体激活的转录因子,可调节多种先天性和适应性免疫细胞的活性,它可以与许多免疫抑制配体(如犬尿氨酸)结合。 AHR 上调 PD-1 和 CD8 阳性 T 细胞; 它还可以诱导 Treg 细胞并抑制 IFN,从而导致免疫抑制和肿瘤发生。
众所周知,尿路上皮癌患者具有高水平的 AHR 信号激活。 IK-175 引发激活的 T 细胞状态、白介素 22 基因表达,并导致促炎细胞因子增加。
早期试验正在积极招募患有局部晚期或转移性实体瘤的患者参加研究的剂量递增部分,以及那些已经用尽剂量标准治疗选择的不可切除、局部复发或转移性尿路上皮癌的患者 -扩张阶段。 值得注意的是,扩展队列被丰富到包括那些肿瘤表达高水平 AHR 的尿路上皮癌患者。
剂量递增部分使用了 mTPI2 设计。 研究参与者接受的 IK-175 剂量范围为每天一次 200 至 1200 毫克,单药治疗组每天两次 800 毫克,与纳武单抗联合使用时每天一次 800 毫克至 1200 毫克,纳武单抗的剂量为 480 mg 每 4 周一次。 扩展队列采用 Simon 2 阶段设计; 这需要在研究的第一阶段至少有一名响应者才能进入第二阶段。
该试验的主要终点是评估 IK-175 的安全性和耐受性,并确定该药物的最大耐受剂量和推荐的 2 期剂量。 此外,次要终点包括药代动力学(PK)、总体反应率、无进展生存率、DOR、疾病控制率、治疗持续时间和免疫药效学终点。 探索性终点包括额外的 PK 和 AHR 靶基因变化。
共有 42 名患者在试验中接受了治疗。 在这些患者中,中位年龄为 70 岁(范围 28-83 岁),并且将近一半 (41.9%;n = 22) 为女性。 此外,25% 的患者接受过 1 到 3 种先前的治疗,49% 的患者接受过 3 到 10 种先前的治疗。 68% 的患者之前接受过抗体-药物偶联物的治疗。 所有参与者在最后一次服用任何 CPI 后 12 周内都经历了疾病进展,包括原发性难治性或对 nivolumab 耐药的参与者。
对于安全性分析,数据截止日期为 2022 年 9 月 22 日。共纳入 26 名接受单药治疗的患者和 17 名接受联合治疗的患者。 4 名接受 IK-175 单一疗法的患者和 5 名接受 IK-175 联合治疗的患者具有高 AHR 表达。
没有观察到剂量限制性毒性,并且在任何治疗组中探索的任何剂量都没有达到最大耐受剂量。 值得注意的是,选择 1200 mg 每天一次用于尿路上皮癌患者的扩展队列。
所有患者都经历过任何级别的治疗紧急不良反应 (TEAE); 这些影响在 58.1% 的患者中为 3 级或更高。 大多数这些影响的严重程度为 1 级或 2 级。 TEAE 分别导致 16.3%、7.0% 和 9.3% 的患者剂量调整、中断或停药。
60.5% 的患者发生了治疗相关的 AEs (TRAEs),这些影响在 16.3% 的患者中为 3 级或更高。 单药治疗组最常见的 TRAE 是皮疹和恶心; 在组合臂中,他们感到疲劳和味觉障碍。 此外,44.2% 的患者经历了严重的 AE; 这些影响与 2 名患者的治疗有关。 单药治疗组的一名患者出现 3 级全身无力,联合治疗组的 1 名患者出现 3 级免疫相关关节炎。
双臂患者均出现免疫相关毒性。 最常见的免疫相关 AE 包括斑丘疹 (11.6%)、全身无力 (4.7%)、免疫介导性关节炎 (2.3%) 和肾上腺功能不全 (2.3%)。
研究作者总结说:“两个治疗组的剂量扩展阶段 2 继续招募。”
参考资料:
Aggen D, McKean M, Lakhani N, et al. Initial results from a phase 1a/b study of IK-175, an oral AHR inhibitor, as single agent and in combination with nivolumab in patients with advanced solid tumors and urothelial cancer. Journal for ImmunoTherapy of Cancer. 2022;10. doi:10.1136/jitc-2022-SITC2022.066


