Cell:改造成功!一种进化的AAV变体能够对小鼠T细胞进行高效转导
时间:2023-01-19 15:01:42 热度:37.1℃ 作者:网络
利用同源定向修复将大基因精确靶向到T细胞已经成为过继细胞治疗和T细胞生物学的变革性手段。通过腺相关病毒(adeno-associated virus,AAV)传递DNA模板大大提高了敲入效率,但目前AAV血清型的趋同性限制了它们在免疫缺陷小鼠模型中使用的人T细胞。
2023年1月12日,美国加州大学旧金山分校Justin Eyquem课题组与杜克大学Aravind Asokan课题组合作在Cell 杂志在线发表题为“An evolved AAV variant enables efficient genetic engineering of murine T cells”的研究论文,该研究采用结构引导进化方法进化出AAV变体Ark313,该变体源于AAV6,在小鼠T细胞中表现出高转导效率。研究发现Ark313可以用于瞬时基因传递和精确的基因组工程。
Ark313可用于在小鼠环境中模拟来自人类T细胞的各种工程策略,研究提出了基因靶向策略,扩展了基因工程T细胞在体内研究中的使用。此外,通过全基因组敲除筛选,确定了一个基本的小鼠宿主因子和Ark313细胞进入的机制。总之,高效的小鼠T细胞基因靶向为改进细胞疗法提供了巨大的潜力,并为实验T细胞免疫学开辟了道路。

几十年的研究已经将T淋巴细胞置于适应性免疫和耐受性的中心。在工程T细胞基因组和调节基因表达的能力方面的进展,对于我们理解T细胞在健康和疾病中的发育和功能的调节至关重要。最近,经工程改造表达嵌合抗原受体(CAR)的T细胞在治疗恶性血液病方面已经发生了转变,人们对将这种方式扩展到实体瘤的治疗有很大的兴趣。T细胞最常见的重组基因传递载体是复制缺陷逆转录病毒,如γ-逆转录病毒(γ-retroviruses,gRVs)或慢病毒,由于变异导致半随机整合和可变转基因表达。位置效应可导致异质T细胞功能、转基因沉默和插入性肿瘤发生,这限制了这些治疗产品的有效性和安全性。
基因编辑技术的进步已经能够在原代人类T细胞中精确整合转基因,并拓宽了实验和临床T细胞工程策略的范围。已经证明,在内源性启动子的控制下,CAR在TCRα常数(TCRα constant,TRAC)位点上的靶向整合可使生理受体表达,并在异种移植小鼠模型中产生与γ-逆转录病毒传递相比具有更高抗肿瘤活性的T细胞。靶向TRAC位点的基因也被报道用于提高转基因(transgenic,Trg) TCRs的活性。使用类似的方法,最近以一种不依赖HLA的方式重塑了TCR对靶细胞表面抗原的特异性,这种不依赖HLA的TCR (HLA-independent TCR,HIT)受益于TCR位点和结构的生理信号转导和抗原敏感性。
在T细胞的背景下,只有具有免疫能力的模型才能概括肿瘤微环境或自身免疫生态位的复杂性。然而,确定一种有效且无毒的方法,将大量DNA货物靶向小鼠T细胞仍然是难以捉摸的。转录激活物样效应核酸酶(TALEN) mRNA或Cas9核糖核蛋白(RNP)的核修饰已被用于产生敲除基因,但同源定向修复模板(homology-directed repair template,HDRT)的传递一直是大敲除基因的瓶颈。HDRT已使用腺相关病毒血清型6 (AAV6)或DNA,传递到人T细胞,其中AAV6仍然是更有效和毒性更小的方法。与人类T细胞相反,试图通过对短ssDNA或dsDNA HDRT进行核修饰(用于产生单核苷酸突变)来编辑小鼠T细胞,结果是低靶向性(<10%)和高毒性(50%-85%细胞死亡)AAV有可能解决这些问题,但到目前为止,还没有一种AAV血清型能够高效转导小鼠T细胞,因此,对具有这一趋同性的AAV变体的需求还没有得到满足。
为此,多种方法,包括在AAV衣壳表面表位的合理工程,通过DNA改组的定向进化,肽插入库,3D结构引导进化,以及最近的机器学习,已被用于生成具有改变取向的AAV变体,提高转导效率,和/或逃避中和抗血清的能力。最近证明了通过修饰表面足迹的AAV衣壳库的感染循环在进化的AAV变体中实现受体切换的可行性。
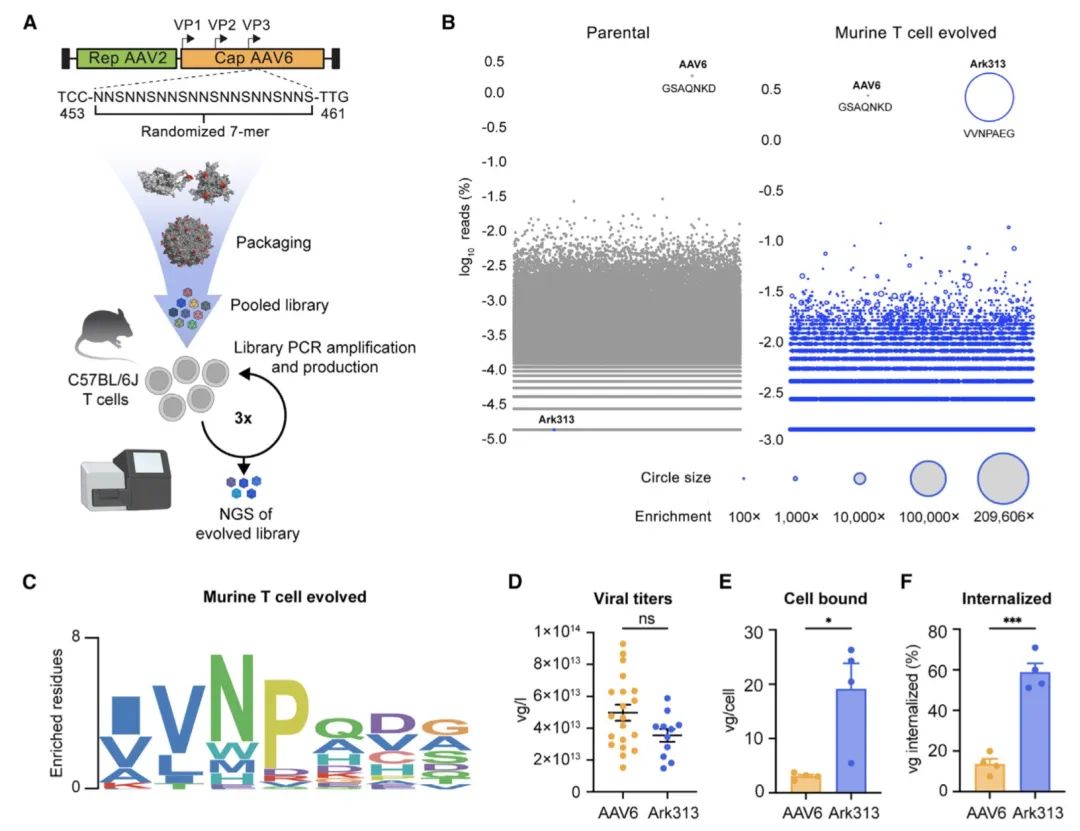
图1. 结构引导进化鉴定了具有小鼠T细胞取向的AAV衣壳变体(图源自Cell )
为了在小鼠T细胞中实现靶向敲入,该研究进化了Ark313,一种在小鼠T细胞中表现出高转导效率的合成AAV。研究进行了全基因组敲除筛选,并确定QA2是Ark313感染的重要因素。研究还证明Ark313可用于无核感染的DNA传递、CRISPR-Cas9介导的敲除和大基因的靶向整合。此外,Ark313还能够在免疫活性模型中对靶向靶向的CAR-T和转基因TCR-T细胞进行临床前建模。
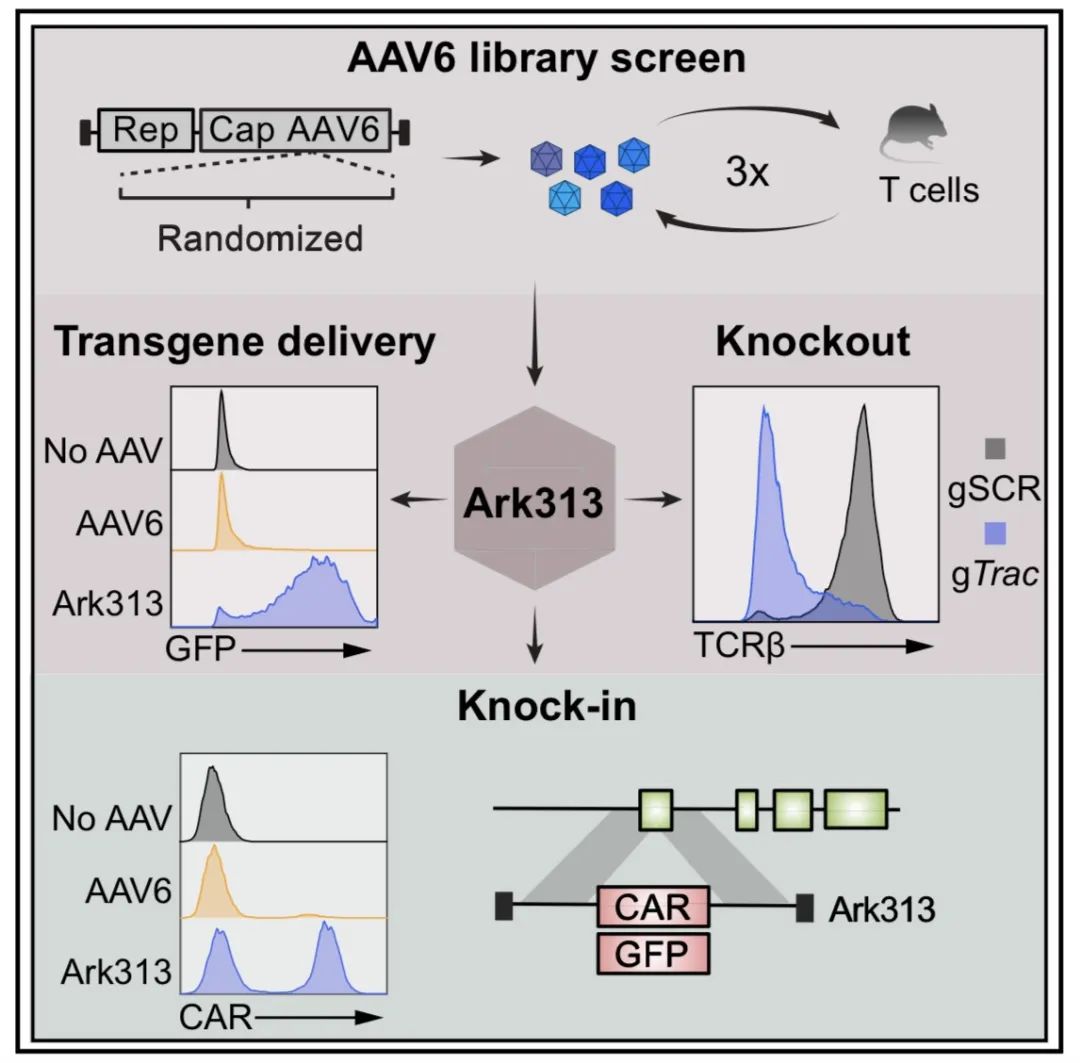
图2. 研究概述(图源自Cell )
总的来说,这项研究进化出的Ark313为实验性T细胞免疫学和在具有免疫能力的宿主中精确工程细胞疗法的临床前建模开辟了道路。虽然该研究重点是癌症免疫治疗,但重定向T细胞特异性的应用范围超出了癌症小鼠模型。在不需要培育Trg TCR小鼠的情况下,敲入任何TCR来取代内源性TCR的潜力,为研究自身免疫中的T细胞提供了可能性。预计Ark313将成为加速发现免疫活性模型和临床转译中细胞治疗模式的基本工具。
原文链接:
https://doi.org/10.1016/j.cell.2022.12.022


