Commun Biol:间歇性禁食“神话”被打破?最新研究显示,母体间歇性禁食可破坏肠道屏障,导致后代代谢紊乱!
时间:2023-01-18 06:01:29 热度:37.1℃ 作者:网络
在过去的二十年中,间歇性禁食(IF)已成为体重管理和代谢益处的有效干预措施。除了大规模的人体干预研究外,动物研究还证实了间歇性禁食的代谢益处。间歇性禁食方案代谢益处的机制在很大程度上仍然未知,但可能涉及肠道微生物组、生物节律和生活方式行为。
尽管有大量研究集中在间歇性禁食的代谢益处上,但其对后代健康的影响在很大程度上仍未确定。肠道是营养消化和吸收的主要器官,在宫内发育过程中容易受到母体营养环境的影响,母亲间歇性禁食是否会改变后代肠道稳态目前尚不清楚。
因此,本研究报道了怀孕前的长期母体IF通过抑制有益的微生物群(如Lactobacillus intestinalis,肠乳杆菌)来破坏后代的肠道屏障,导致随后的葡萄糖和脂质代谢功能障碍。
 间歇性禁食的代谢益处
间歇性禁食的代谢益处
与M-AL动物相关的M-IF小鼠的体重和食物摄入量有中度减少。M-IF小鼠的葡萄糖耐量显著改善。胰岛素耐量和肝脏重量基本保持不变。肾周白色脂肪组织(rWAT)、辅助白色脂肪组织(pWAT)和皮下白色脂肪组织(sWAT)的脂肪量略有减少。这些结果表明间歇性禁食对母体代谢有益。
母亲间歇性禁食会恶化后代的新陈代谢和肠道屏障
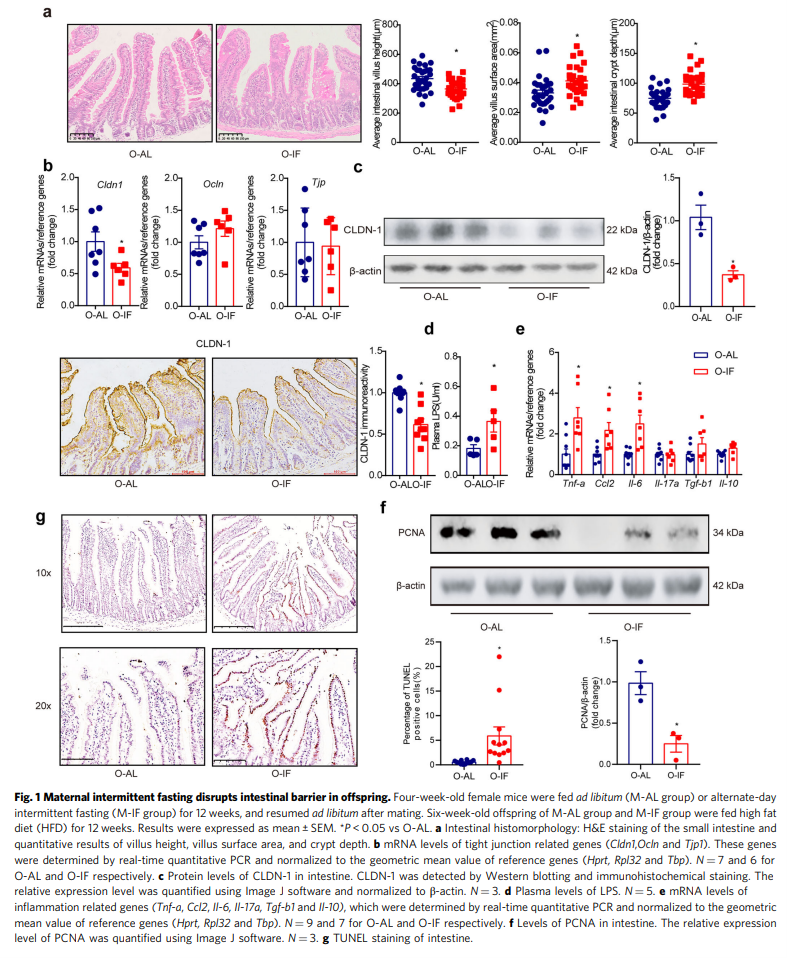
接下来,研究人员研究了母体间歇性禁食对高脂饮食(HFD)小鼠后代的影响。间歇性禁食诱导喂养HFD的后代肠道屏障发生深刻改变。绒毛高度(P = 0.0003)显著降低,而绒毛表面积(P = 0.003)和隐窝深度(P<0.0001)增加(图1a)。O-IF后代的短短肠绒毛提示肠上皮结构的改变。然后研究人员检查了细胞间紧密连接,这对肠道屏障至关重要。在紧密连接相关的三个主要基因中,cldn-1的mRNA (P = 0.0417)(图1b)和蛋白(P = 0.0112)(图1c)水平均显著降低。CLDN-1的减少与循环LPS的大量增加相关(图1d),表明肠屏障被破坏。此外,肠道Tnf-a (P <0.0001)、Ccl2 (P = 0.0056)和Il-6 (P = 0.0002) mRNA水平显著升高(图1e)。肠上皮细胞增殖细胞核抗原(PCNA)水平显著降低(P = 0.0127)(图1f), TUNEL染色显示细胞凋亡显著增加(P = 0.008)(图1g)。
母亲间歇性禁食会破坏后代肠道微生物群,其特征是肠乳杆菌显著减少
肠粘膜屏障与肠道微生物群相互作用以维持肠道稳态。为了研究母亲间歇性禁食是否会改变后代的肠道微生物群,研究人员进行了16 S rRNA测序,以分析肠道内容物标本中的细菌群落结构。Shannon指数显示,喂食NCD或HFD的O-IF小鼠的α多样性显着降低(图2a)。图2b为各类群中相对丰度较高的物种及其在种水平上的比例。值得注意的是,在喂食NCD或HFD的O-IF小鼠中,Lactobacillus_intestinalis的相对丰度降低(图2c)。与O-AL NCD组相比,饲喂HFD的O-AL小鼠Lactobacillus_intestinalis的相对丰度显著降低(P = 0.0126)。为了分析O-AL和O-IF后代之间微生物群落的统计差异,研究人员将OTU与LEfSe分析进行了比较。LDA评分>104的物种见图2d,包括O-AL后代的g_Streptococcus, f_Streptococcaceae, g_Candidatus Arthromitus, f_unknown Clostridiales, s_lactobacillus _testinalis, f_Lachnospiraceae, s_Streptococcus danieliae,,O-IF动物的g_Methylocystis。由LEfSe分析生成的分支图(图2e)显示,相对于O-AL后代,喂食NCD或HFD的O-IF后代富集的类群差异最大。同样,O-AL后代在乳酸杆菌家族中表现出更高的丰度。所有这些结果表明,无论是喂养NCD还是HFD, O-IF后代的肠道微生物群落结构都发生了显著的破坏。在这些细菌中,肠道乳酸杆菌Lactobacillus_intestinalis是导致O-IF后代肠道微生物群在物种水平上减少的主要系统型。

肠乳杆菌恢复母体间歇性禁食小鼠后代的肠屏障功能障碍
接下来,研究人员研究了恢复肠道乳酸杆菌Lactobacillus_intestinalis(L. intestinalis)是否可以挽救喂养HFD的O-IF后代肠屏障功能障碍的表型。实验设计如图3a所示。给药L. intestinalis可恢复O-IF后代肠绒毛的变化,其表现为肠绒毛高度增加(P = 0.0002),同时肠绒毛表面积减少(P = 0.0087)(图3b)。肠隐窝深度基本保持不变(图3b)。此外,用L. intestinalis治疗逆转了CLDN-1的减少(P = 0.0273)(图3c)。血浆LPS (P = 0.038)(图3d)和Tnf-a (P = 0.005)(图3e)的增加也相反。其他细胞因子(图3e)仅显示微弱衰减。因此,L. intestinalis可恢复母体间歇性禁食小鼠后代的肠屏障功能障碍。

乳酸杆菌改善母体间歇性空腹小鼠后代葡萄糖和脂质代谢紊乱
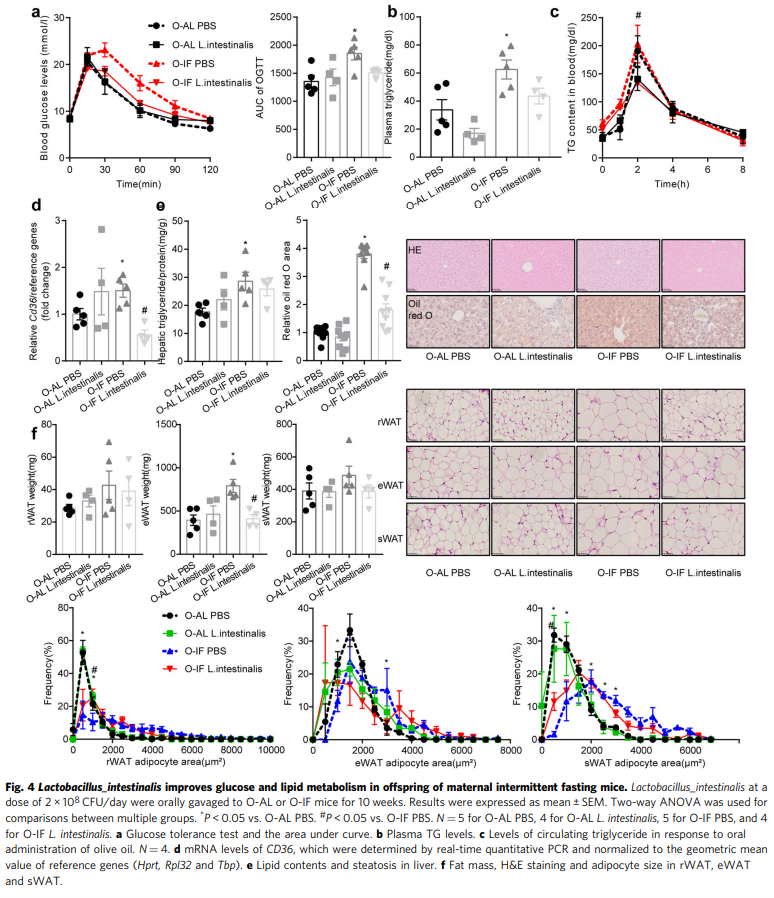
接下来,我们研究了喂养HFD的O-IF后代肠道屏障功能障碍的代谢后果。在O-IF后代中观察到糖耐量显著受损(图4a)和循环甘油三酯升高(P = 0.0196)(图4b)。肝脏甘油三酯含量升高(P = 0.0456), H&E和油红O染色显示脂肪变性升高(图4e)。肾周白色脂肪组织(rWAT)、附睾白色脂肪组织(eWAT)和皮下白色脂肪组织(sWAT)的脂肪量和脂肪细胞大小增加(图4f)。服用L. intestinalis可逆转糖耐量受损(图4a)以及血浆甘油三酯(图4b)、脂质吸收(图4c)、肠道Cd36 (P = 0.0008)(图4d) 的增加、通过油红O和H&E染色测量的肝脏脂肪变性(图4e)和肥胖(图4f)。
与健康小鼠共居的母体间歇性禁食小鼠的后代恢复肠道屏障功能障碍
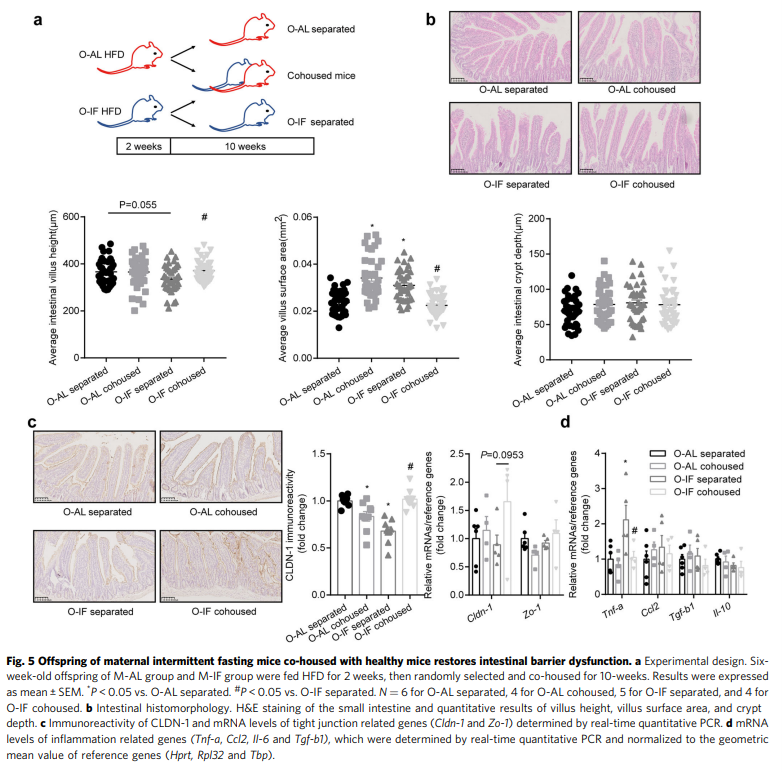
由于共舍实验已被证明对肠道微生物群的转移是有效的,研究人员使用这种方法来确定来自健康小鼠的微生物转移是否可以挽救饲喂HFD的母体IF后代的肠道屏障功能障碍。实验设计概述如图5a所示。共住10周后,检查肠屏障。与健康小鼠共居的O-IF显示肠绒毛高度(P = 0.0175)和表面积(P<0.0001)恢复(图5b), cldn-1 mRNA (P = 0.0953)和蛋白质(P < 0.0001)减少(图5c), Tnf-a增加(P = 0.0071)(图5d)。另一方面,与O-IF共居的O-AL出现肠屏障功能障碍,表现为相对于分离的O-AL,共居的O-AL发生了肠上皮结构的显著变化和CLDN-1免疫反应性,表明相互转移和肠道菌群的转移及其对肠屏障的影响。因此,健康小鼠中微生物群的可转移成分可以挽救母体IF后代的肠屏障功能障碍。
与健康小鼠共居的母体间歇性禁食小鼠的后代显示出葡萄糖和脂质代谢的改善
O-IF与健康O-AL的共居逆转了葡萄糖和脂质代谢功能障碍(图6)。与单独饲养的O-IF相比,与健康小鼠共安置O- IF可显著改善糖耐量(图6a),降低血浆甘油三酯(P = 0.0464)(图6b),降低脂质吸收(图6c),通过油红O和H&E染色测量肝脏脂肪变性(图6d),以及白色脂肪组织的脂肪量和脂肪细胞大小所证明的肥胖(图6e)。同时,与O-IF共安置的健康O-AL小鼠表现出葡萄糖和脂质代谢受损(图6)。

综上所述,本研究表明,母体间歇性禁食会破坏肠道屏障,导致葡萄糖和脂质代谢紊乱。这些影响是通过微生物群失调发生的,其特征是有益细菌(如Lactobacillus_intestinalis)的显着减少。这次观察进一步支持了这样一个概念,即后代肠道菌群容易受到母体营养的影响,其稳态对肠道屏障的完整性和代谢稳态至关重要。
原文来源:
Liang Y, Yin W, Luo C, Sun L, Feng T, Zhang Y, Yin Y, Zhang W. Maternal intermittent fasting in mice disrupts the intestinal barrier leading to metabolic disorder in adult offspring. Commun Biol. 2023 Jan 12;6(1):30. doi: 10.1038/s42003-022-04380-y. PMID: 36631606; PMCID: PMC9834385.


