难治突变的春天 EGFR20ins再迎两款重磅新药
时间:2023-01-15 12:01:38 热度:37.1℃ 作者:网络
近日,中国国家药监局(NMPA)官网最新公示,武田(Takeda)申报的1类新药琥珀酸莫博赛替尼胶囊(mobocertinib)已通过优先审评获得附条件获批,用于含铂化疗期间或之后进展且携带表皮生长因子受体20号外显子插入突变(EGFR 20ins)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。而迪哲医药的舒沃替尼片也于近日拟纳入优先审评,针对适应症为携带EGFR 20ins的局部晚期或转移性NSCLC成人患者。难治突变突变再迎来两大新药,今天我们就来聊一聊难治突变20ins.
2023
难治突变20INS
肺癌中大约有85%属于非小细胞肺癌(NSCLC),EGFR突变是NSCLC常见的基因突变类型。EGFR 20号外显子插入(EGFR Exon20ins)突变与EGFR敏感突变不同,其独特的蛋白结构使得传统EGFR-TKI、免疫治疗与化疗对这类患者的治疗效果不佳,因此被称之为难治突变。那么20ins有那些治疗药物呢?
1
amivantamab
2021年5月,FDA加速批准强生公司研发生产的EGFR/c-Met双抗Rybrevant (amivantamab-vmjw,JNJ-6732) 上市,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。这是FDA批准的首个针对该类突变的药物。
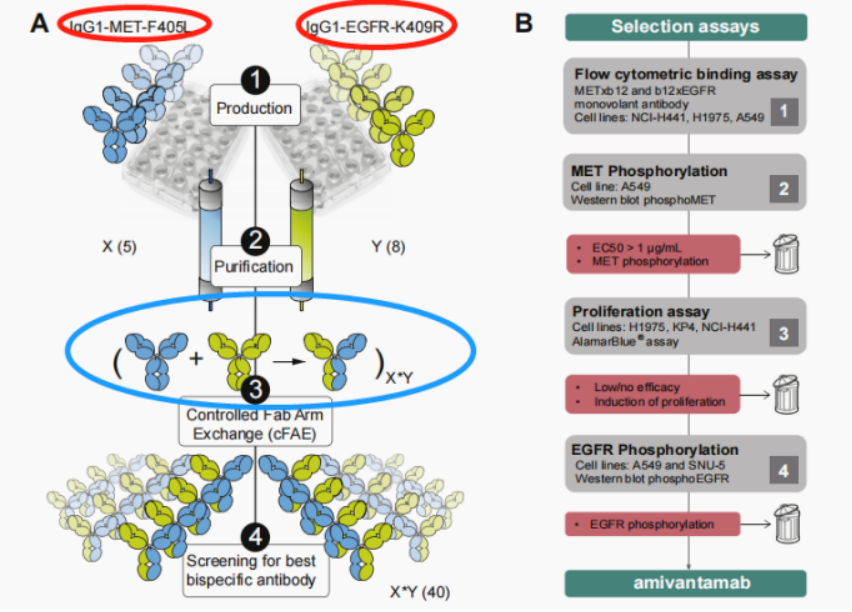
Amivantamab(JNJ-61186372)是靶向EGFR和cMet的双特异抗体,属于EGFR和MET双靶的单抗静脉输注型药物,与既往的EGFR口服TKI决然不同。该双抗采用1+1的非对称形式(IgG1),抗体的一个Fab结合cMet靶点,另外一个Fab结合EGFR靶点。带有两个单点突变的抗体先分别在两个细胞株中进行生产,并进行纯化。纯化后的两个单克隆抗体在体外按照一定比例混合,经过还原和氧化处理形成异源二聚体双特异抗体,且具有ADCC效应。
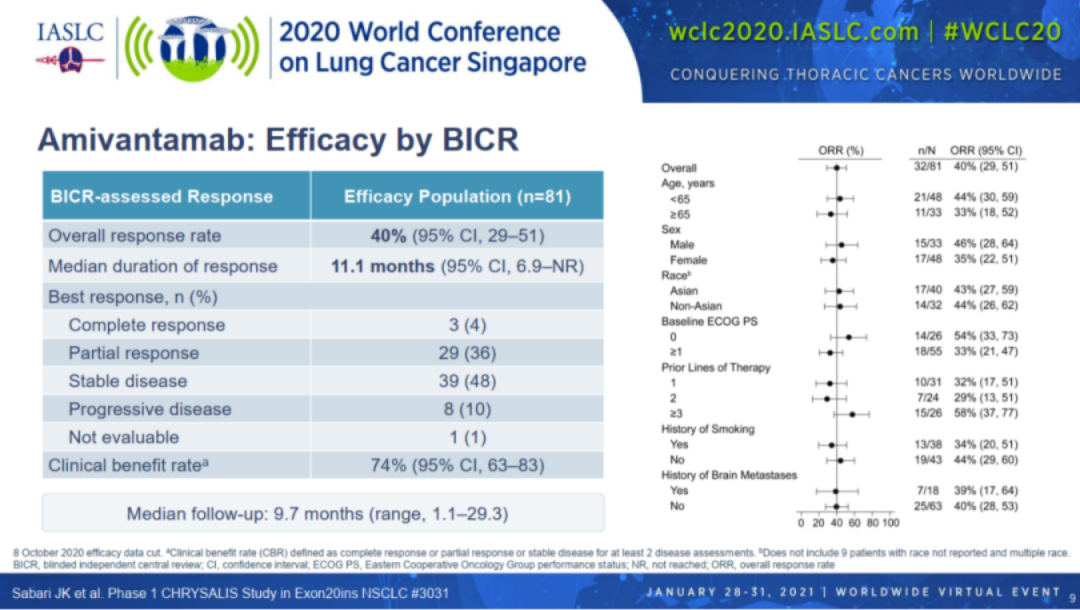
该批准是基于2020年WCLC会议上上更新的I期CHRYSALIS研究中amivantamab单药疗法队列的阳性结果,该研究共纳入81例既往接受过一线铂类化疗的EGFR 20ins的肺癌患者,疾病进展后均接受Amivantamab治疗。体重<80kg的患者接受1050 mg剂量,体重≥80 kg患者的剂量为1400 mg。
中位随访9.7个月后, 客观缓解率(ORR)为40%,其中完全缓解率CR为4%,部分缓解率PR为36%,中位缓解时间DoR为11.1个月。临床获益率(定义为在至少两次疾病评估中完全或部分缓解或疾病稳定)为74%。而20ins使用目前上市的1-3代TKI来说,疗效非常有限,10%以下。目前,Amivantamab联合化疗(培美曲塞+卡铂)一线治疗EGFR 20ins的NSCLC的III期研究PAPILLON(NCT04538664)正在进行,这是Amivantamab一线挑战EGFR 20ins标准化疗的大型开放标签、随机对照的III期研究。
进一步分析显示,ctDNA或具有一定的疗效预测作用,Amivantamab对不同插入区域EGFR 20ins均被证实有效。其中Helical Region(n=1)ORR高达100%;Near Loop (n=54) ORR为41%;Far Loop(n=8) ORR为25%。

amivantamab在安全性方面基本可控,≥3级治疗相关不良反应发生率为16%,最常见的不良反应:皮疹,与输液有关的反应,指甲或脚趾甲周围的皮肤感染,肌肉和关节疼痛,呼吸急促,恶心,疲劳,小腿或手或面部肿胀,溃疡。口腔,咳嗽,便秘,呕吐和某些血液检查的变化。
2
mobocertinib(TAK788)
2021年9月15日,美国食品药物管理局(FDA)批准了武田制药的mobocertinib上市申请,适应症为用于治疗在含铂化疗治疗期间或治疗后进展的局部晚期或转移性的EGFR 20ins患者。Mobocertinib是武田研发的一种新型、高选择性、靶向 EGFR 20ins的口服酪氨酸激酶抑制剂(TKI),作为EGFR 20ins第二款获批药物,可以说是众望所归!
在中国,mobocertinib曾于2020年9月被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种,拟用于治疗既往至少接受过一次全身化疗的携带EGFR 20号外显子插入突变的局部晚期或转移性NSCLC患者。2021年7月,武田在中国递交了mobocertinib针对上述适应症的新药上市申请并获得受理,该申请随后又被CDE纳入优先审评。
该决定是基于一项试验 NCT02716116 1/2 期的结果。
试验的第 1 部分采用剂量递增的 3+3 设计,纳入了 ECOG 体能状态低于2 的晚期 NSCLC 患者。其中6 名患者之前接受过铂类治疗。
在研究的第二部分,即扩展阶段,在以下 7 个队列中以 160 毫克的日剂量对莫博替尼进行了评估:
队列 1(n = 22):既往接受过铂类治疗、患有难治性EGFR外显子 20 插入阳性疾病且没有活动性、可测量的中枢神经系统 (CNS) 转移的患者;
队列 2:患有难治性疾病和HER2外显子 20 插入或点突变且没有活动性、可测量的 CNS 转移的患者;
队列 3:患有难治性疾病和EGFR或HER2外显子 20 插入或点突变以及可测量的活动性 CNS 转移的患者;
队列 4:初治患者或患有其他EGFR突变(有或没有T790突变、罕见EGFR突变)的难治性疾病患者;
队列 5:先前对 EGFR TKI 有反应的难治性疾病和EGFR外显子 20 插入患者;
队列 6:EGFR外显子 20 插入的初治患者;
队列 7:具有EGFR / HER2突变的难治性疾病和其他肿瘤类型(非 NSCLC)患者;
该试验的第 3 部分包括一个 EXCLAIM 扩展队列,该队列包括 96名先前接受过铂类治疗的EGFR外显子 20 插入阳性患者(n = 86)。
在 2021 年 ASCO 年会上公布的最新数据,患者的客观缓解率(ORR)为28%,疾病控制率(DCR)为78% ,中位缓解持续时间(DoR)为 17.5 个月,中位无进展生存期(PFS)为 7.3 个月,中位总生存期(OS)为 24 个月。
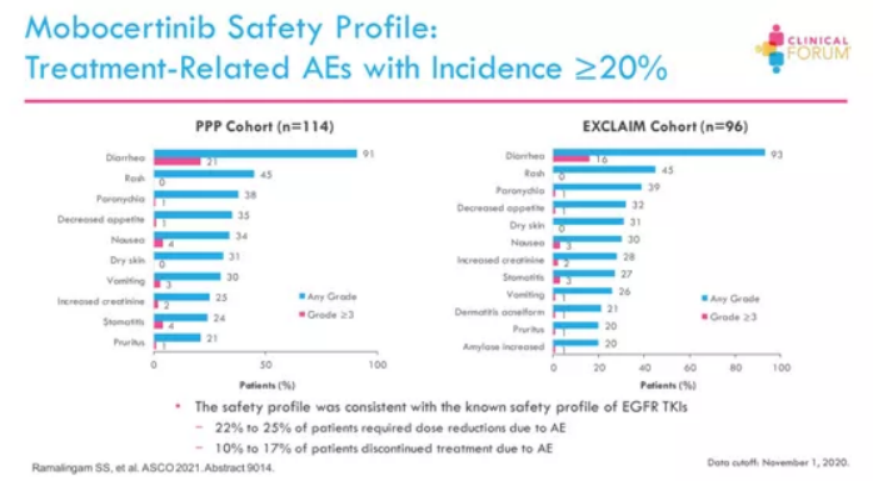
在安全性方面,安全性与EGFR TKI的已知安全性一致,有22%-25%的患者发生了AE,需要调整减少剂量,10%-17%的患者因发生AE停止治疗。
3
舒沃替尼
舒沃替尼是迪哲医药研发的一款口服、不可逆、针对多种EGFR突变亚型的高选择性EGFR-TKI。它对包括Exon20ins突变在内的多种EGFR和HER2突变都有较强活性,同时还对野生型EGFR具有高选择性。2022年5月,迪哲医药宣布国际知名期刊《癌症发现》(Cancer Discovery)已发表了舒沃替尼的药物研发、转化科学和临床研究成果。
在2022年欧洲肿瘤内科学会(ESMO)年会和2022年中国临床肿瘤学会(CSCO)上,舒沃替尼的一项在中国进行的开放、单臂、多中心2期注册试验数据公布,研究纳入既往接受过铂类化疗、携带EGFR exon20ins的晚期NSCLC患者。截至2022年7月31日,经盲态独立中心评估委员会(BICR)判定,舒沃替尼的这项中国注册研究达到了主要终点。接受舒沃替尼治疗的97例患者,客观缓解率(ORR)达到了59.8%;31例基线伴有脑转移的患者占比32%,他们经确认的ORR达到48.4%;研究共纳入30种EGFR exon20ins突变亚型,不论插入突变发生位置,均观察到抗肿瘤活性。
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


