Front.agingneurosci-蛋白质乙酰化改变在神经退行性疾病中的作用
时间:2023-01-12 21:02:11 热度:37.1℃ 作者:网络
乙酰化是参与组蛋白和非组蛋白调节的关键翻译后修饰过程 (PTM)。它控制DNA 转录、RNA 修饰、蛋白质稳态、衰老、自噬、细胞骨架结构的调节和新陈代谢等细胞过程。乙酰化对于维持神经元可塑性至关重要,因此对于记忆和学习至关重要。乙酰化的稳态是通过组蛋白乙酰转移酶 (HAT) 和组蛋白去乙酰化酶 (HDAC) 的活性来维持的。
在阿尔茨海默氏病 (AD)、帕金森氏病 (PD) 和亨廷顿舞蹈症在内的几种神经退行性疾病中,这些受到严格调控的过程发生了改变。过度乙酰化和低乙酰化都会损害神经元的生理稳态并增加病理生理蛋白的积累,此外,乙酰化失调还与轴突运输受损有关。这篇文章讨论了蛋白质乙酰化的生理作用,并检索了当前描述神经退行性疾病中蛋白质乙酰化改变的相关研究。
 乙酰化
乙酰化
乙酰化是通过向蛋白质结构添加乙酰基来调节所有哺乳动物细胞的功能和活力的关键生物学过程,翻译后乙酰化涉及多种过程,例如维持细胞稳态、蛋白质折叠和蛋白质定位,并且是一个受到严格调控的过程。参与维持这种稳态的酶被称为组蛋白乙酰转移酶 (HAT) 和组蛋白脱乙酰酶(HDAC)。
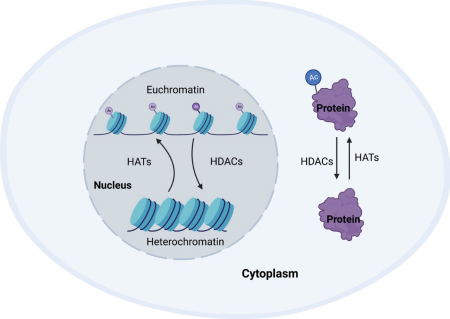 图1 由组蛋白乙酰转移酶 (HAT) 和组蛋白脱乙酰酶 (HDAC) 调节的细胞稳态
图1 由组蛋白乙酰转移酶 (HAT) 和组蛋白脱乙酰酶 (HDAC) 调节的细胞稳态
乙酰化改变在神经退行性疾病中的作用
许多不同的 PTM 与神经退行性疾病的发病机制有关。在神经退行性疾病中,乙酰化改变与通过自噬和蛋白体导致蛋白质清除机制失败有关。有研究报告称,p300/CBP 酶活性的增加改变了自噬通量,导致转基因 AD 小鼠中 tau 蛋白的过度分泌。此外,HDAC 抑制剂 4b(优先抑制 HDAC1 和 HDAC3 酶)被证明可以通过蛋白酶体和溶酶体途径清除亨廷顿蛋白来改善转基因 HD 小鼠模型的认知功能。
蛋白质稳态改变也可能由蛋白质聚集引起,这是神经退行性疾病的病理生理学标志。聚集被认为是由易于聚集的蛋白质中发生的几种不同条件引起的,例如突变、氧化应激或改变的 PTM 导致蛋白质错误折叠并产生不溶性聚集体。这些聚集体被认为会损害神经元的结构和功能活动,从而进一步促进 AD、PD、FTLD、HD 和 ALS 疾病的致病过程。
大多数研究蛋白质聚集和 PTM 之间联系的研究都集中在异常磷酸化上,然而,由于大多数与疾病相关的蛋白质可以乙酰化,乙酰化的改变可能导致神经退行性疾病中的蛋白质错误折叠和蛋白质聚集形成。
(1)AD 和 PD 中的 Tau (MAPT)
Tau 是一种微管相关蛋白 (MAP),在组装和稳定微管方面起着至关重要的作用。在tau蛋白病的转基因小鼠模型中,位于 tau 蛋白微管结合区的氨基酸 KXGS 基序被低乙酰化,这表明会损害 tau 活性并导致在神经原纤维缠结。此外,该序列的过度磷酸化会阻止 tau 乙酰化,这会再次导致 tau 从微管中解离,从而降低微管和轴突运输的稳定性。
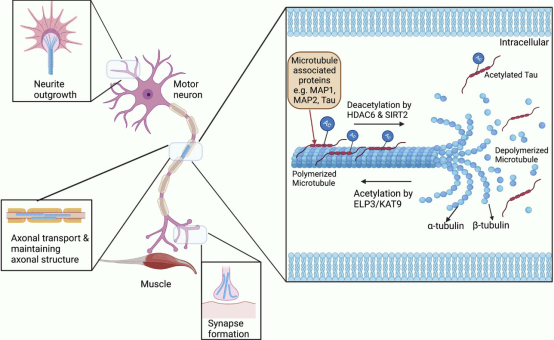 图2 乙酰化和脱乙酰化对微管稳定性的作用
图2 乙酰化和脱乙酰化对微管稳定性的作用
PD 和路易体痴呆中的α-突触核蛋白
α-突触核蛋白聚集体是 PD 和路易体痴呆的核心病理。在正常情况下,这种蛋白质主要存在于神经元突触前末梢,并参与调节突触小泡运输以释放神经递质。α-突触核蛋白会发生N端乙酰化,从而调节其与微管蛋白、肌动蛋白和脂质的结合。此外,在PD研究中,α-突触核蛋白在第 6 位和第 10 位赖氨酸的乙酰化改变导致聚集,导致突触核蛋白病和神经元毒性。
ALS 中的超氧化物歧化酶 1
活性氧清除酶超氧化物歧化酶 1 (SOD1) 是与 ALS 中的神经变性相关的关键病理蛋白。研究表明,受 SIRT1 调控的赖氨酸 70 的乙酰化导致 SOD1 的抗氧化功能失活。此外,赖氨酸位点 122 的乙酰化抑制了线粒体呼吸,随后增加了 SOD1 的氧化应激清除活性。一项研究表明,在 SOD1 敲除 ALS 模型中,赖氨酸 123 乙酰化的改变促进了蛋白质聚集和发病机制。不仅赖氨酸 123 的乙酰化增加,而且高水平的乙酰化SOD1的错误折叠蛋白聚集在星形胶质细胞的初级纤毛和源自这些初级纤毛的囊泡中,这些含有错误折叠的乙酰化 SOD1 的囊泡被神经元吸收,导致神经变性。
总结
乙酰化在维持细胞蛋白质和细胞骨架的稳态中起着关键作用,这种受到严格监管的过程已被证明在神经退行性疾病中失调;然而,其潜在的病理生理机制尚未完全了解。通过新兴疗法,改变乙酰化水平可能成为限制或预防神经退行性疾病中导致蛋白质聚集或轴突运输缺陷的有效策略。


