Mol Cancer:毛捷/吴丁兰/张隆基合作发现治疗胶质母细胞瘤的潜在新方法
时间:2023-01-12 12:01:49 热度:37.1℃ 作者:网络
胶质母细胞瘤(glioblastoma,GBM)是最具侵袭性和致死性的人类脑肿瘤,尽管包括手术切除、放疗和化疗在内的联合治疗,但患者的预后仍然很差。嵌合抗原受体(CAR)-T疗法结合了单克隆抗体对肿瘤抗原的特异性识别和T细胞的肿瘤杀伤功能,为癌症治疗提供了一种新的策略。
双唾液酸神经节苷脂GD2在正常组织中主要表达于神经元细胞膜上,在许多恶性肿瘤中也有高表达。在脑肿瘤中,GD2在80%弥漫性固有桥脑胶质瘤(diffuse intrinsic pontine glioma,DIPG)的肿瘤表面富集。在动物研究表明,CAR-T细胞抗GD2可有效消除原位植入小鼠的GD2阳性人GBM和DIPG肿瘤,且无明显的神经毒性或脱靶效应。最近,报道了4例编码组蛋白H3 (H3K27M)突变的DIPG基因或脊髓弥漫性中线胶质瘤(diffuse midline glioma,DMG)患者使用GD2特异性CAR-T细胞治疗的临床经验。这些早期结果强调,GD2特异性CAR-T治疗H3K27M突变的DIPG和脊髓DMG是安全的,具有临床益处。考虑到GD2在正常的神经组织中表达,而抗GD2抗体治疗成神经细胞瘤与神经性疼痛相关,进一步临床探索GD2特异性CAR-T细胞治疗GBM是有必要的。
2023年1月9日,深圳市人民医院毛捷团队、南方医科大学深圳医院吴丁兰团队与深圳市免疫基因治疗研究院张隆基团队合作在Molecular Cancer 杂志在线发表题为“Safety and antitumor activity of GD2-Specific 4SCAR-T cells in patients with glioblastoma”的研究论文,该研究旨在验证输注GD2特异性第四代安全设计嵌合抗原受体(fourth-generation safety-designed CAR,4SCAR)-T细胞是否安全,以及CAR-T细胞是否具有抗胶质母细胞瘤活性。
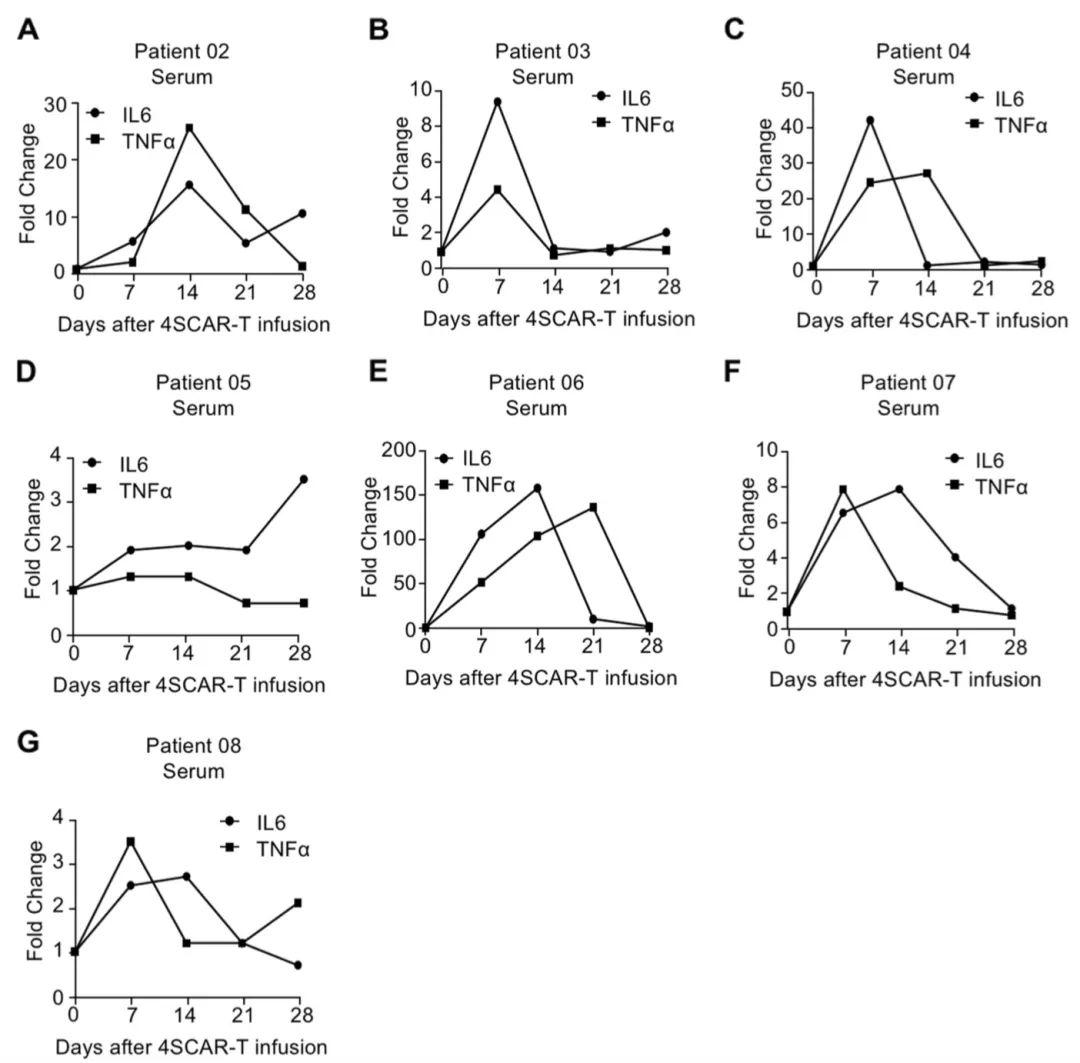
研究表明单独和联合输注GD2特异性4SCAR-T细胞靶向GBM是安全的,耐受性良好,无严重不良事件。此外,GD2特异性4SCAR-T细胞在肿瘤微环境中部分介导抗原丢失并激活免疫反应。

CAR-T疗法对血液系统癌症(包括非霍奇金淋巴瘤、慢性淋巴细胞白血病和急性淋巴细胞白血病)显示出巨大的前景。最近,在迄今为止最长的CAR-T治疗随访研究中,60%接受CAR-T治疗的B细胞淋巴瘤患者在5年时仍处于缓解状态。然而,CAR-T治疗实体瘤的挑战仍然存在,只有少数患者预后良好。先前的研究发现了四个主要障碍,包括异质抗原表达、受损的CAR-T细胞适应性、CAR-T细胞归巢和穿透有限,以及免疫抑制微环境。
抗原选择对CAR-T细胞功能至关重要,而异质性抗原表达导致CAR-T细胞的靶向抗原有限。充分有效的CAR-T细胞运输到肿瘤部位对CAR-T治疗至关重要。然而,CAR-T细胞输注后适应度受损,CAR-T细胞对实体瘤的归巢和穿透受限,在很大程度上阻碍了肿瘤杀伤效果。免疫抑制细胞积聚在肿瘤微环境中,损害CAR-T细胞的肿瘤杀伤效果。此外,免疫抑制细胞通过分泌多种抑制性细胞因子产生对CAR-T细胞不利的环境。
目前正在研究用表达不同CAR的转基因T细胞进行GBM的免疫治疗。CAR-T细胞靶向白介素(interleukin,IL)-13Rα2、表皮生长因子受体变体III (epidermal growth factor receptor variant III ,EGFRvIII)和人表皮生长因子受体2 (human epidermal growth factor receptor 2,HER2)治疗GBM的临床试验已经完成。尽管CAR-T细胞治疗GBM的安全性已在这三个试验中得到证实,但由于抗原逃逸和肿瘤异质性,CAR-T细胞作为单一疗法在GBM中并不是特别有效。除了IL-13Rα2、EGFRvIII和HER2外,CAR-T治疗GBM的各种靶点已经被确定。
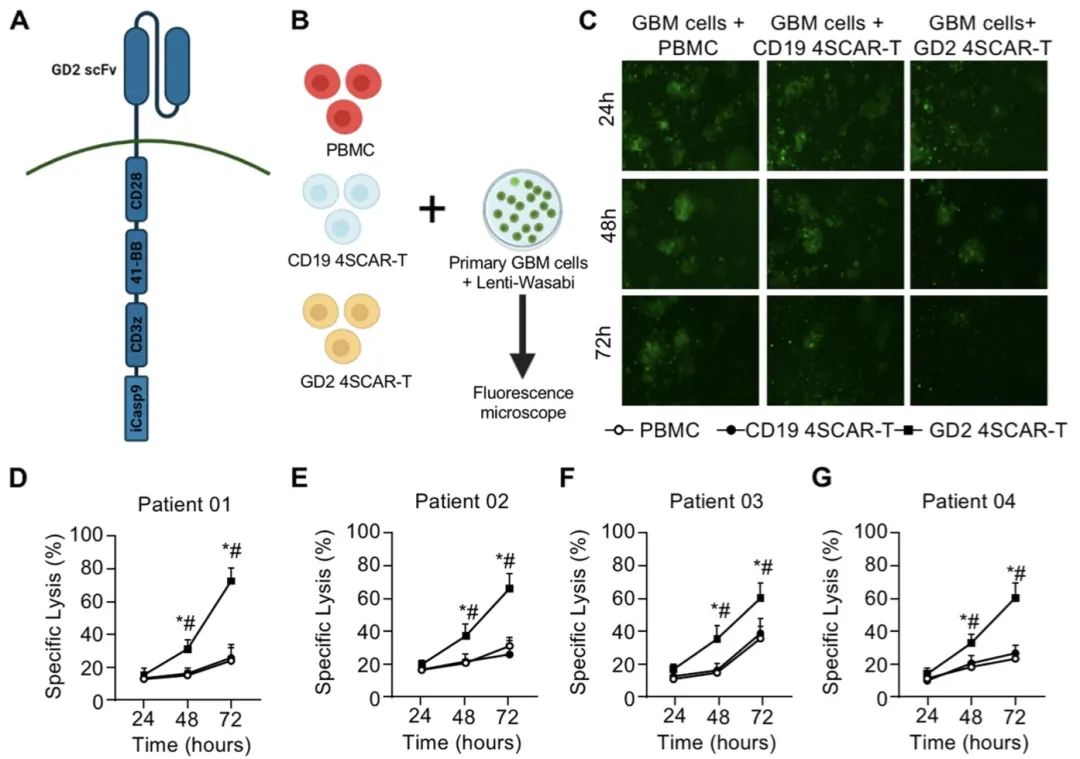
为了解决安全性问题并提高抗肿瘤疗效,这项研究使用了第四代安全设计的CAR (4SCAR)。4SCAR由CD28跨膜和细胞质结构域、共刺激的4-1BB胞内TRAF结合结构域、CD3z链胞内结构域和诱导自杀的caspase 9基因组成。通过对进行性GBM患者注射GD2特异性4SCAR-T细胞进行了一期试验,并报告了其安全性、持久性和肿瘤杀伤疗效。
图1. GD2特异性4SCAR - T细胞的设计和杀伤试验(图源自Molecular Cancer )
结果表明,4SCAR-T细胞扩增1-3周,并在外周血中以低频率持续存在。在8例可评估患者中,4例在输注后3至24个月出现部分缓解,3例在输注后6至23个月病情进展,1例在输注后4个月病情稳定。对于整个队列,中位总生存期为输注后10个月。在输注后切除的肿瘤中观察到GD2抗原缺失和T细胞浸润。
图2. GD2特异性4SCAR‐T细胞输注后外周血细胞因子的调节(图源自Molecular Cancer )
综上所述,这项研究表明通过两种不同的途径向GBM患者输注自体GD2特异性4SCAR-T细胞是安全且耐受性良好的。此外,GD2特异性4SCAR-T细胞在肿瘤微环境中部分介导抗原丢失并激活免疫反应。虽然在一些患者中观察到寿命延长和GD2特异性抗原丢失,但由于样本量小,但该研究无法确定临床获益。研究的初步临床试验强调了GD2特异性4SCAR-T细胞靶向GBM的安全性,并且有必要进一步评估GD2特异性4SCAR-T细胞的二期研究。
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-022-01711-9