临床研究|慢性乙型肝炎患者合并极轻肝脂肪变性的临床特征及危险因素分析
时间:2023-07-31 13:22:40 热度:37.1℃ 作者:网络
随着经济发展和生活方式的改变,非酒精性脂肪性肝病(NAFLD)的患病率迅速增长,在我国其患病率约为30%[1]。同时,NAFLD合并CHB患者的数量也明显上升,高达32.8%[2]。病理学诊断NAFLD的最低标准为5%脂肪变性,1%~4%的脂肪变性被认为是极轻度或偏低的脂肪变性[3]。多项研究分析了CHB合并NAFLD的危险因素,而CHB合并极轻脂肪变性的研究则较少。既往研究[4]表明,约有1/4的CHB患者合并极轻肝脏脂肪变性,此类患者中大多数将进展至NAFLD。分析该类患者临床特征及相关危险因素,有助于疾病的早期识别及干预。
1 资料与方法
1.1 研究对象
回顾性选取2018年7月-2022年3月南京大学医学院附属鼓楼医院感染疾病科行肝穿刺活检的CHB患者179例,依据组织病理学脂肪变性程度分为无脂肪变性组(n=98)、极轻脂肪变性组(n=81)。无脂肪变性定义为肝组织病理学未见脂肪变性,极轻脂肪变性定义为存在1%~4%的脂肪变性。
入组标准:
- (1)HBsAg阳性>6个月;
- (2)未行抗病毒治疗;
- (3)脂肪变性程度<5%。
排除标准:
- (1)肝组织病理学脂肪变性程度≥5%;
- (2)合并HCV、HIV、HDV、EBV、CMV等;
- (3)已接受抗病毒治疗;
- (4)合并其他肝脏疾病(如肝豆状核变性、自身免疫性肝病、药物性肝病、酒精性肝病、HCC等);
- (5)服用引起肝脏脂肪变性的药物(主要是皮质类固醇、他莫昔芬和甲氨蝶呤等);
- (6)服用降脂类药物和降尿酸药物;
- (7)饮酒史(男性酒精摄入量>20 g/d,女性>10 g/d)。
1.2 研究方法
1.2.1 基本信息及临床资料
收集患者年龄、性别、饮酒史、疾病史、用药史等。人体测量包括身高、体质量、BMI。临床数据包括生化学、乙型肝炎五项定量、HBV DNA、血常规和肝脏脂肪受控衰减参数(CAP)。临床数据检查时间在肝穿刺活检前不超过2周。
1.2.2 肝组织病理学检查
肝活检在经皮超声引导下进行。脂肪变性分级参照NASH-CRN评估方案[3]。肝脏炎症和纤维化病理诊断采用Scheuer评分系统[5]。显著炎症分级定义为≥G2,显著纤维化分级定义为≥S2。
2 结果
2.1 无脂肪变性组与极轻脂肪变性组的基线特征
极轻脂肪变性组男性及显著纤维化比例、BMI、尿酸(UA)、TG、CAP、ALT、AST、GGT水平高于无脂肪变性组,差异均有统计学意义(P值均<0.05)(表1)。两组炎症及纤维化等级分布见图1。
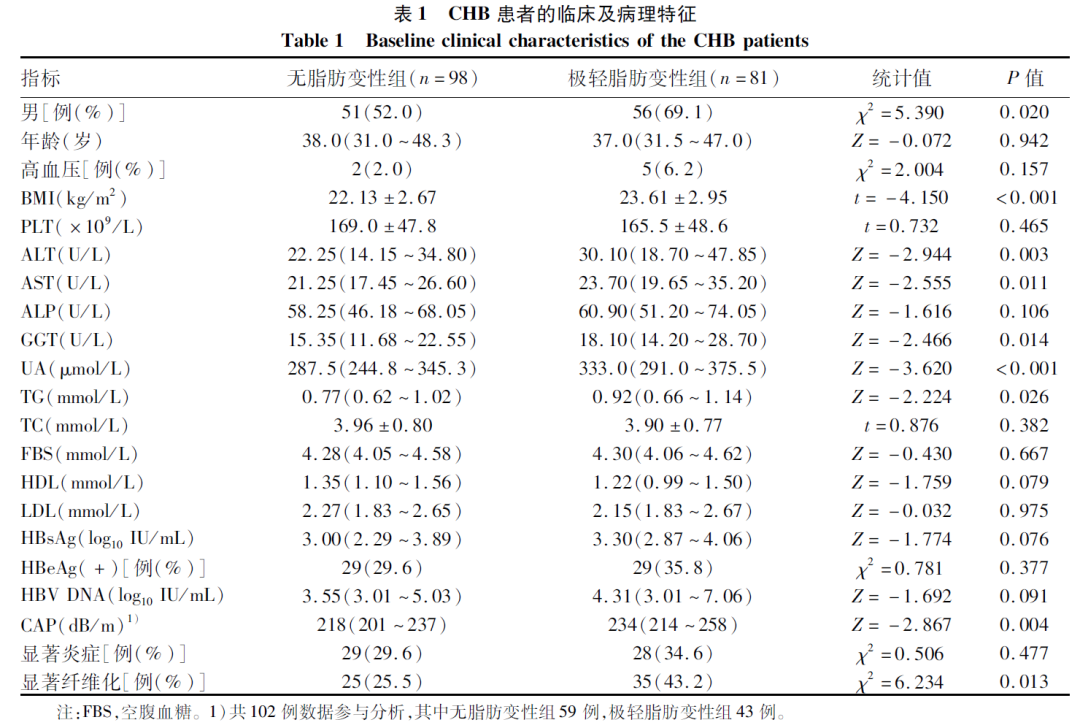
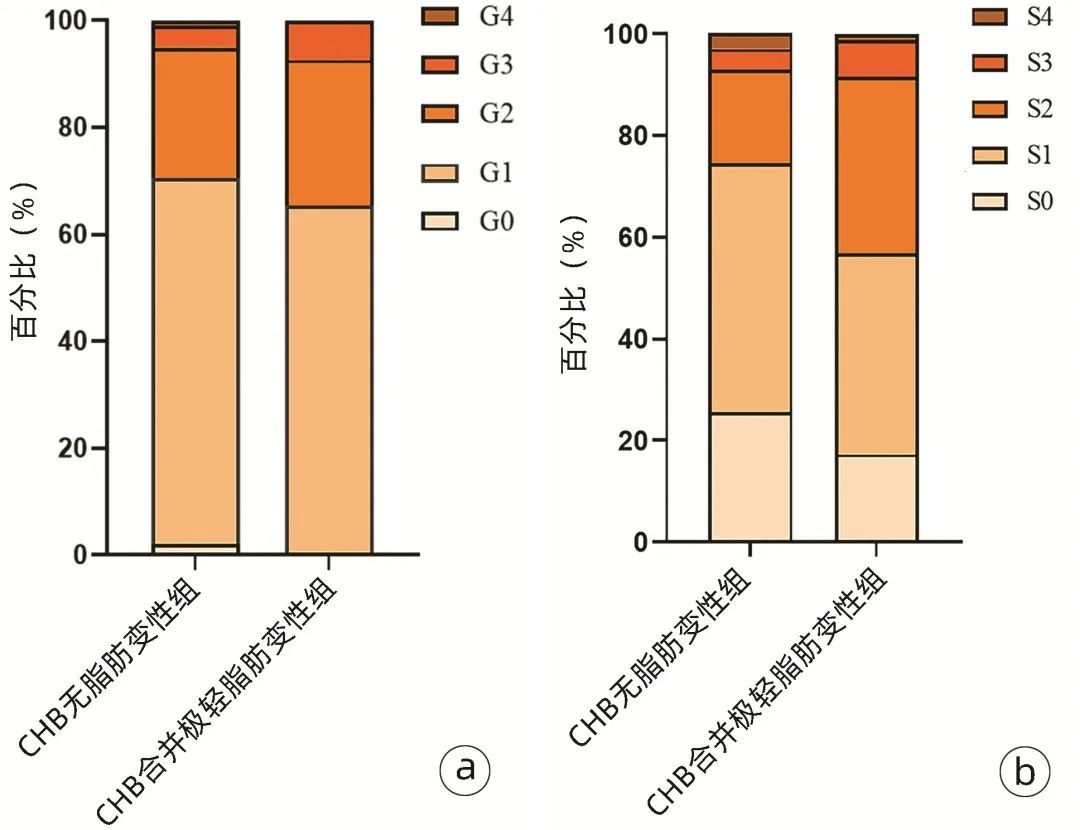
图1 炎症及纤维化等级分布
注:a,炎症等级;b,纤维化等级。
2.2 正常体质量组与超重组的基线特征分析
依据BMI将CHB患者分为体质量过低组(BMI<18.5 kg/m2)、正常体质量组(18.5 kg/m2≤BMI<24 kg/m2) 与超重组(BMI≥24 kg/m2)。随着BMI升高,极轻脂肪变性比例逐渐增加,分别为0、38.4%、66.7%,3组间比较差异有统计学意义(P<0.001)。不同BMI水平极轻脂肪变性分布情况见图 2。正常体质量组,极轻脂肪变性患者UA、HBV DNA高于无脂肪变性患者(P值均<0.05)。超重组,极轻脂肪变性者PLT低,显著纤维化比例高(P值均<0.05)(表2)。
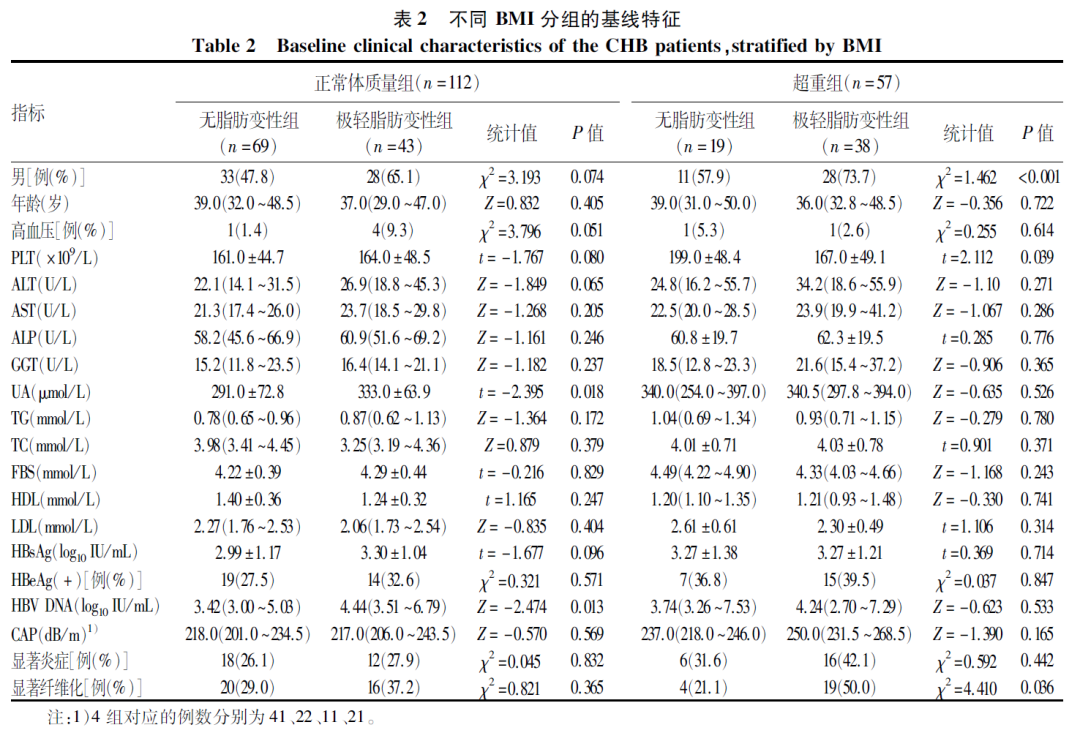
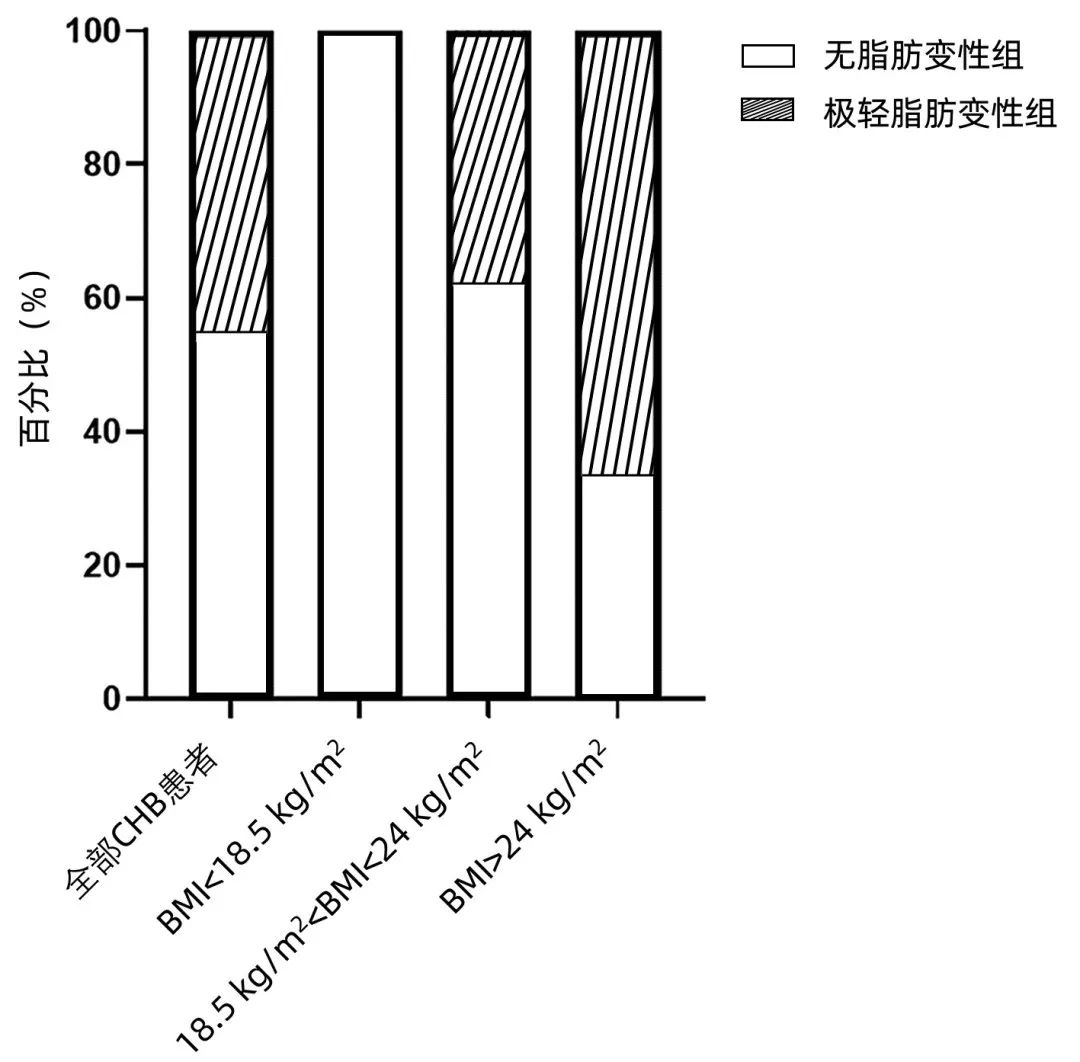
图2 不同BMI水平极轻脂肪变性的分布
正常体质量组,UA四分位间距水平分别为Q1(<259.25 μmol/L)、Q2(259.25~301 μmol/L)、Q3(301~350 μmol/L)、Q4(≥350 μmol/L)。随着UA水平的升高,极轻脂肪变性的比例逐渐升高,分别为21.4%、28.0%、44.8%、56.7%,4组间比较差异有统计学意义(P=0.026),Q1与Q4比较差异有统计学意义(P=0.006)(图3)。
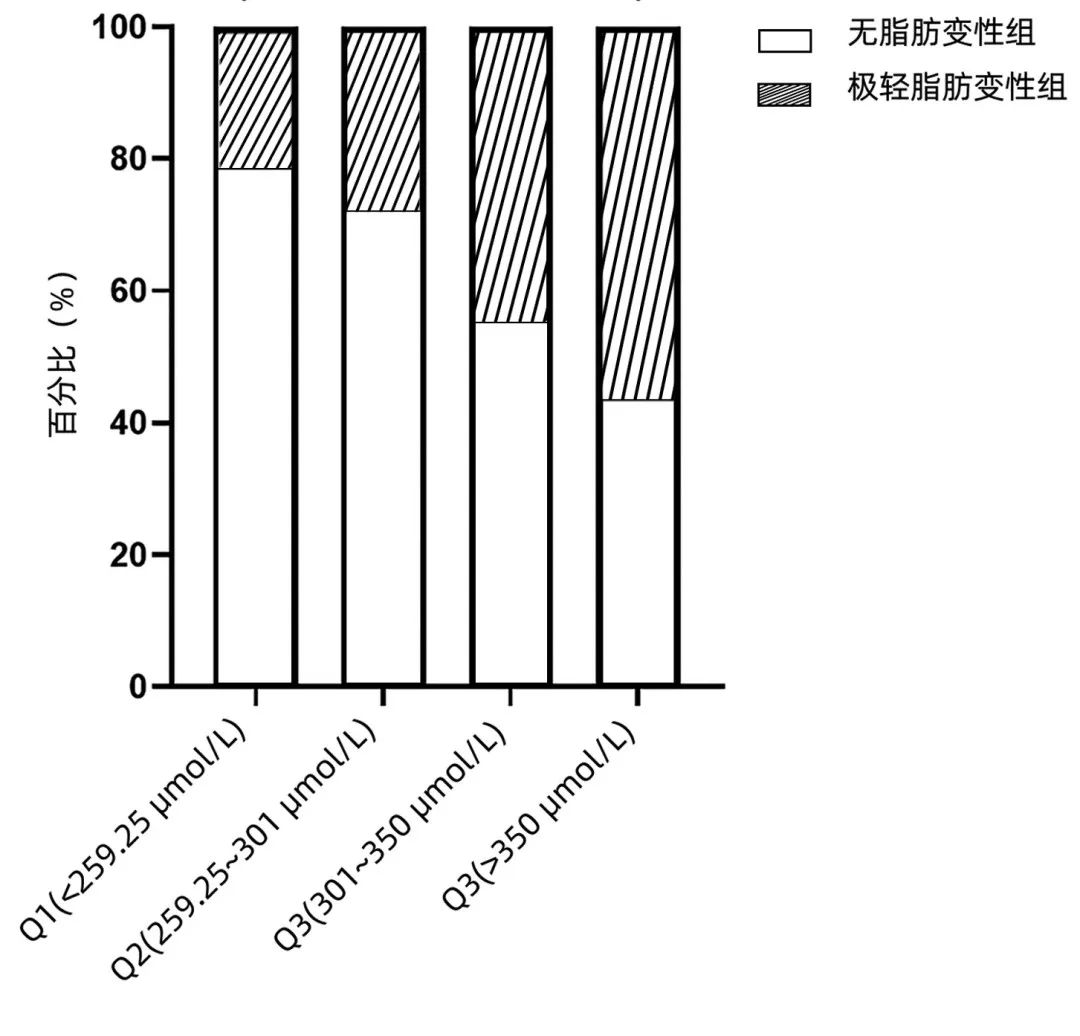
图3 BMI正常组不同UA水平的患者极轻脂肪变性分布
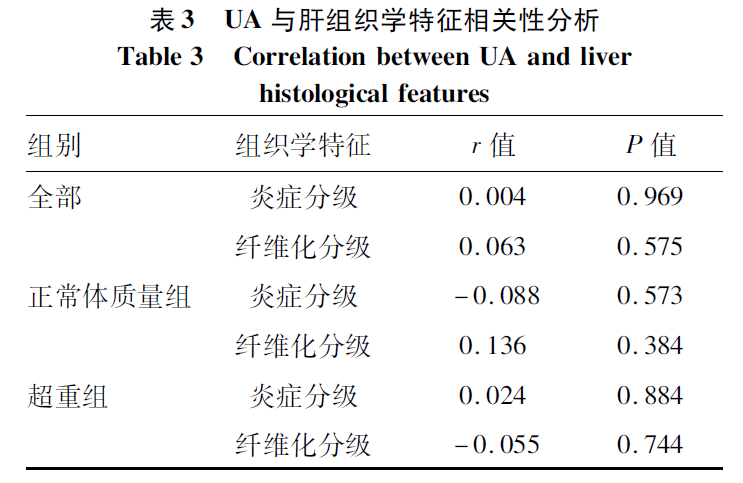
2.3 UA与肝组织学特征相关性分析
在不同组别的CHB合并极轻脂肪变性患者中,UA与炎症及纤维化分级均无显著相关性(P值均>0.05)(表3)。
2.4 CHB合并极轻脂肪变性的危险因素
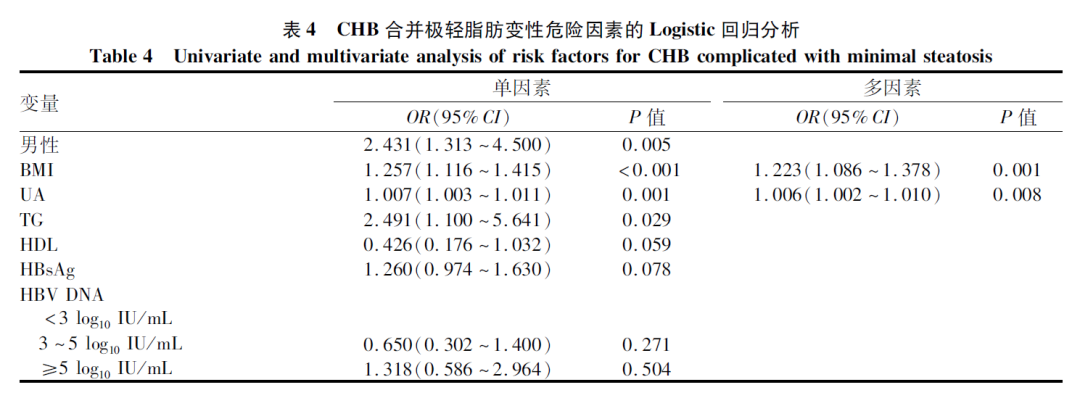
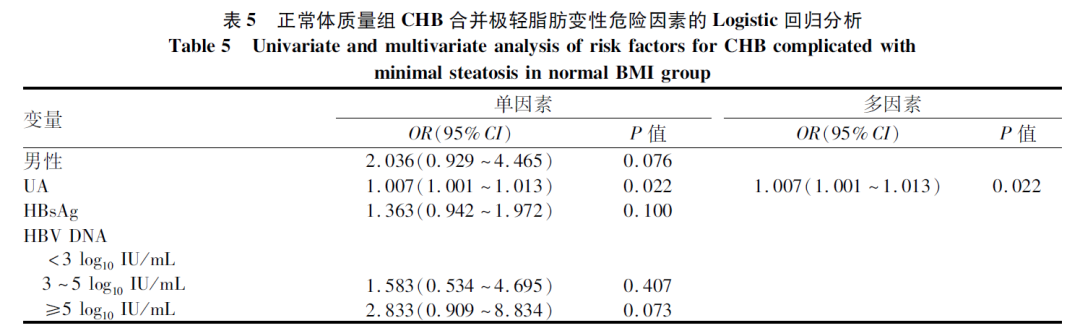
多因素Logistic分析结果显示,BMI和UA为CHB合并极轻脂肪变性的危险因素(P值均<0.05)(表4)。在正常体质量组,多因素Logistic回归结果显示,CHB合并极轻脂肪变性的危险因素为UA(OR=1.007,95%CI:1.001~1.013,P=0.022)(表5)。
3 讨论
随着对CHB合并NAFLD的深入研究,发现该类患者与单纯CHB相比,在代谢及病毒因素方面存在较多差异。但极轻脂肪变性未达到NAFLD的诊断标准,故研究较少。依照疾病发展的规律,该部分患者可认为是CHB合并NAFLD的前期病变,探讨该部分患者临床特征及危险因素,对CHB合并NAFLD的预防具有重要意义。
本研究结果显示,CHB合并极轻脂肪变性组中,男性比例明显升高,可能与男性较易合并代谢危险因素相关。显著纤维化比例亦明显升高,一方面,与该组患者男性比例、肝酶水平、HBeAg阳性比例及HBV DNA载量较高相关,与既往的研究结果一致[6-8];另一方面,随着对代谢因素的重视,很多研究认为BMI增加(如肥胖、超重等)在促进肝纤维进展[9-11]/抑制肝纤维化减轻[12]中发挥重要的作用,BMI的增加对肝脏疾病的进展有促进作用。这一现象在超重组中更加明显,但本研究结果显示,极轻脂肪变性可能对CHB患者肝纤维化也产生影响,需要进一步的大样本临床研究来证实。
CAP可以对肝脏脂肪含量进行定量评估,是目前临床应用较广泛的无创检查。但极轻脂肪变性病变程度轻微,超声检查及肝脏弹性检测技术暂无法对其进行评估及诊断,临床上很难诊断极轻脂肪变性。笔者对CHB合并极轻脂肪变性的CAP进行了探索,发现该类患者的CAP较无脂肪变性的高,更接近于轻度脂肪肝cut-off值,提示CAP在一定程度上可以反映极轻肝脏脂肪变性的存在与否。在正常体质量组和超重组也观察到CAP增高的趋势。但因样本量较小,且存在缺失数据,需要进一步扩大样本量以确定其临床参考价值。
本研究对极轻脂肪变性危险因素的分析结果显示,BMI、UA为CHB合并极轻脂肪变性的独立危险因素,而与HBV DNA载量、HBsAg水平无关,这与既往CHB合并NAFLD危险因素的研究结果相一致[13-17]。提示肝脏脂肪变性与代谢因素相关,而与病毒因素关系不大。既往有研究结果认为正常范围内的UA升高也增加NAFLD的患病风险[18],增加的UA水平与NAFLD独立相关[19]。一项前瞻性队列研究[20]认为UA水平与NAFLD的发生风险呈独立正相关,且在疾病初期独立于其他代谢因素。Zheng等[21]对非肥胖NAFLD患者的研究中得出相同的结论,均与本研究结果基本一致。本研究结果提示UA对脂肪变性的影响可能贯穿于疾病的进展过程。但超重患者亚组中未发现UA水平存在差异,推测BMI升高对超重患者极轻脂肪变性的发生发挥更为重要的作用。由此,推测疾病不同阶段、不同临床特征的患者,UA发挥的作用及作用方式可能存在差别。或者UA对脂肪变的发生没有直接作用,仅为代谢紊乱的标志物。但该研究为横断面研究,无法明确UA与极轻脂肪变性的因果关系。而UA对肝脏脂肪变性及肝组织学改变的作用,已有报道[22]表明,高尿酸血症和肥胖对肝脏脂肪变性和纤维化具有明显的协同作用,建议对肥胖的NAFLD进行UA管理。UA水平不仅与肝脏脂肪变性有关,还与肝损伤[23-24]或肝组织学改变[25-26]有关。但笔者观察到UA与肝组织病理学分级无明显的相关性。造成上述研究不一致的原因可能与本文入组患者脂肪变性程度轻、BMI较低,且未严格定义高尿酸血症有关。因此,UA对脂肪变性程度较轻患者的肝脏病理影响作用需要进一步探讨,以便确定其在脂肪变性中的临床价值。
极轻脂肪变性是NAFLD前期的病理学改变,早期发现、早期干预对改善疾病的预后有重要的意义。本研究数据显示,CHB合并极轻脂肪变性组患者的显著纤维化比例明显高于无脂肪变性的CHB患者,提示极轻脂肪变性对CHB患者肝纤维化也可能产生影响。BMI、UA是CHB患者发生极轻脂肪变性的危险因素,尤其对于正常体质量的患者,UA升高可能与极轻脂肪变性的发生关系更为密切,临床上需要重视该类患者,必要时需对高危患者进行干预。但本研究存在一定的局限性:首先,本研究为横断面研究,需要前瞻性研究以进一步明确UA在肝脂肪变性及肝组织病理学中的作用;第二,本研究为回顾性研究,CAP有缺失,对合并极轻脂肪变性患者的CAP的评估可能存在偏倚;第三,样本量较小,需要大样本、多中心的研究进一步探讨UA的作用。
全文下载
马晓艳, 陈云, 刘嘉城, 等. 慢性乙型肝炎患者合并极轻肝脏脂肪变性的临床特征及危险因素分析[J]. 临床肝胆病杂志, 2023, 39(1): 63-69.


