内镜还是开颅?斜坡和颅颈交界区脊索瘤治疗29年经验分享
时间:2023-07-16 19:11:41 热度:37.1℃ 作者:网络
本研究重点关注这些肿瘤的三个方面的管理:影响切除范围的因素、生存率的预测因素,以及内镜经鼻入路与开颅手术相比的结果。

脊索瘤是颅底肿瘤中最具挑战性的亚群之一,由于其位置深,局部侵袭性强。切除范围(EOR)是一个公认的预后因素,高剂量辅助放射治疗(RT)已显示出对生存结果的积极影响。然而,由于这些肿瘤的深层位置和周围的关键结构,全切除(GTR)仍然具有挑战性。此外,考虑到显微镜下的浸润,斜坡和颅颈交界区(CVJ)脊索瘤的肿瘤R0切除术(R0,显微镜下见≥1mm的瘤周组织内无肿瘤)通常是不可能的。尽管最大限度切除肿瘤后进行质子束放疗(PBRT),复发率仍然很高,5年和10年的无进展生存率(PFS)分别为65%和32%。
在过去的20年里,内镜经鼻入路(EEAs)已经取得了重大的技术进步,并已成为颅底脊索瘤(SBCs)最常见的入路之一。对于最常以斜坡为中心的肿瘤,内镜经鼻是一条合理的手术入路,与传统的开颅手术(OA)相比,可能会增加肿瘤的切除程度,同时降低神经系统的发病率。
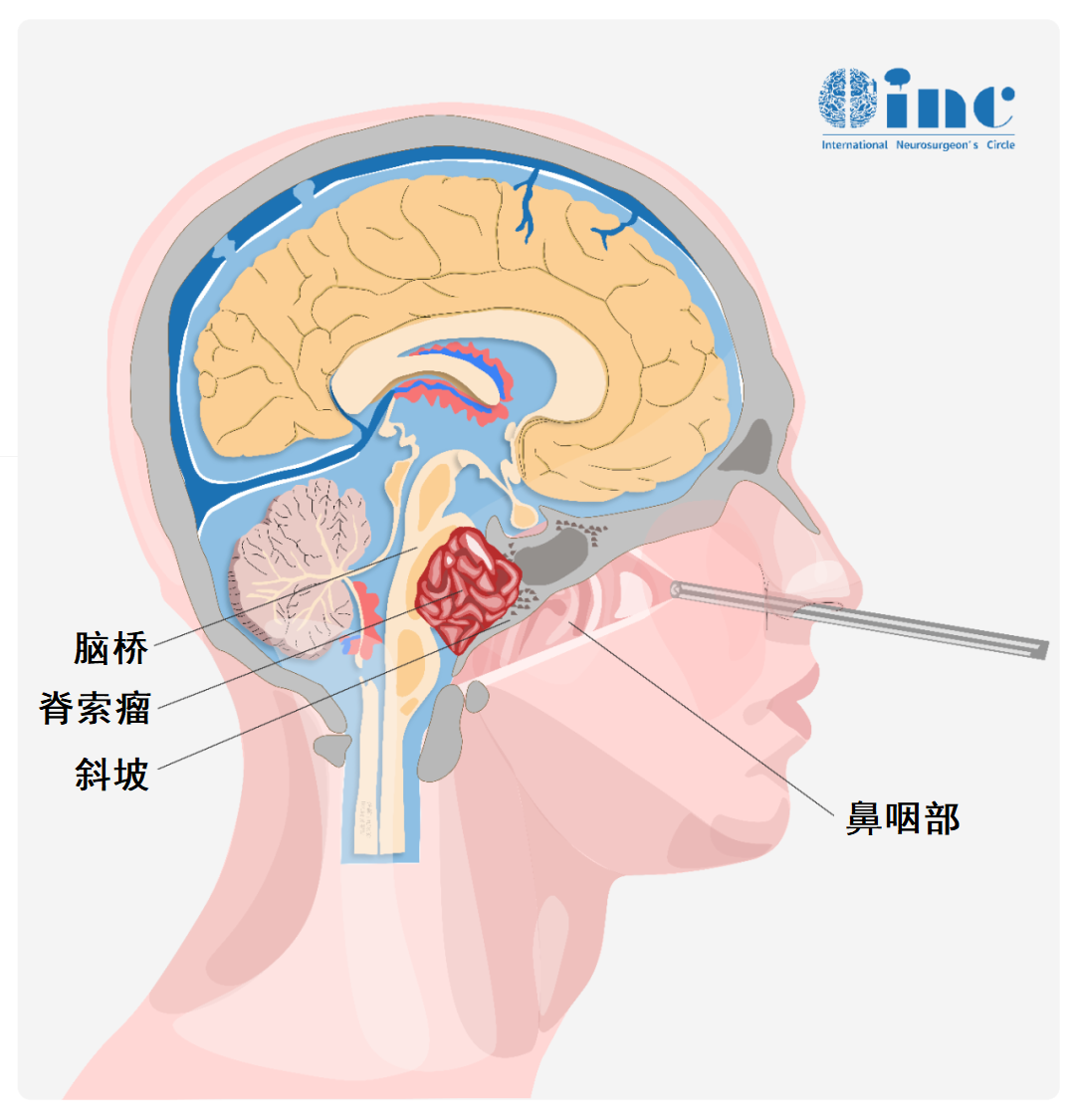
图示为内镜经鼻入路切除脊索瘤
然而,脑脊液渗漏的风险仍然很大,可能导致严重的感染并发症,并且海绵窦、中颅窝底、岩尖、颈静脉孔和颅颈交界区下方的外侧延伸手术仍然具有挑战性。
INC法国Froelich教授专访之脊索瘤治疗篇
由于肿瘤的罕见性,关于最佳治疗策略和方法选择仍存在争议,只有少数大型回顾性研究。高复发率、高手术难度、以及极少数大型研究,这些突出了制定有效治疗策略的重要性。Sebastien Froelich教授及其神经外科手术团队对1991年至2020年在其医院手术治疗的斜坡和颅颈交界区脊索瘤进行了回顾性研究,介绍了他们29年来治疗斜坡和颅颈交界区脊索瘤的经验。

研究结果:210名患者共进行了265次手术,其中包括123例开颅手术(46.4%)和142例内镜经鼻入路(53.6%)。硬膜内延伸、脑干接触关系、海绵窦延伸、大动脉包绕、岩尖延伸或大型肿瘤与切除范围较低显著相关。5年无进展生存率和总生存率(OS)分别为52.1%和75.1%。全切除和Ki-67标记指数<6%被认为是无进展生存率和总生存率延长的独立预后因素。术后放射治疗与较长的无进展生存率独立相关。先前的手术治疗与较低的切除范围和内镜经鼻入路后较高的脑积液渗漏率相关,但与初次手术相比,无进展生存率和总生存率并没有显著降低。先前的放射治疗与较差的结果相关,无进展生存率和总生存率较低。与开颅手术相比,内镜经鼻入路在上斜坡肿瘤和中斜坡肿瘤患者中更频繁地使用,切除范围更好,并且新发神经功能缺损的风险更低。内镜经鼻入路术后脑脊液漏的总发生率为14.8%。
研究结论:这项大型研究表明,在进行放疗之前,应在多学科的颅底中心尝试全切除。为了达到满意的手术结果,内镜经鼻入路应被视为治疗上/中斜坡病变的金标准方法,但开颅手术仍然是治疗大型复杂脊索瘤的重要工具。
Froelich教授对所在医院29年脊索瘤治疗经验的总结
很多大型研究通常受到随访时间的限制,Froelich教授这个系列研究的优势在于,在一个多学科颅底中心,由同时具有丰富内镜经鼻入路和开颅手术经验的神经外科医生治疗,这些患者进行了长期稳定的随访(平均59.2个月)。
01 开颅手术&内镜经鼻入路&“双镜联合”,29年间手术理念如何演变?
肿瘤全切是脊索瘤的一个公认且强有力的预后因素。然而,颅底脊索瘤在保持生活质量(QOL)的同时能提供最佳切除范围的手术方法仍然存有争议。许多开颅手术入路都可以到达斜坡区域,但是这些方法中的大多数需要在关键的神经血管结构之间和周围操作才能到达病变,这可能解释了开颅手术与内镜经鼻入路相比术后神经功能缺损率更高。与许多其他医院一样,我们神经外科在21世纪初引入了内镜经鼻入路,主要用于上斜坡和中斜坡脊索瘤位置(图1C)。
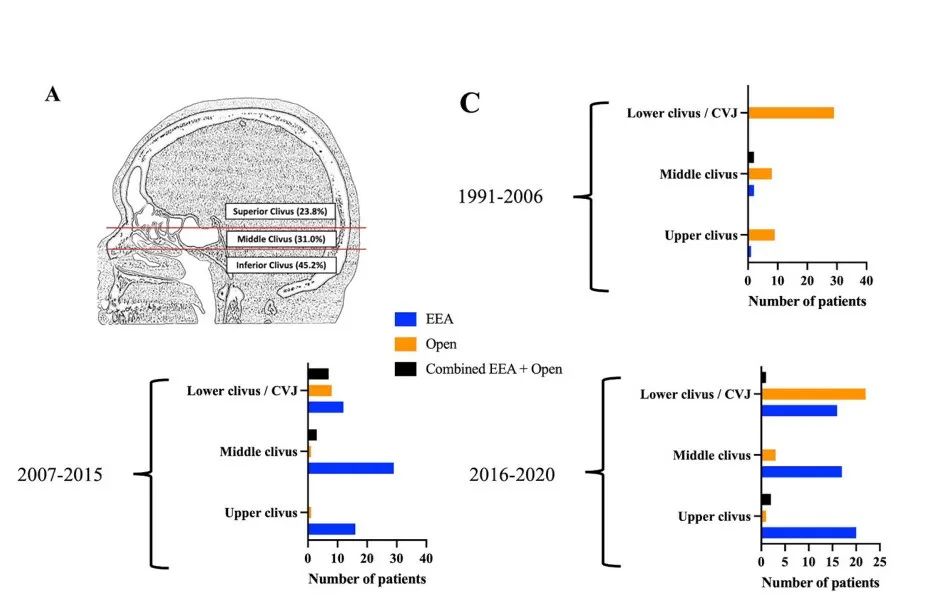
图1:29年来斜坡及颅颈交界区脊索瘤的分类及手术入路的演变。A:脊索瘤的分类根据其沿斜坡的矢状位置和病例的比例。上斜坡脊索瘤起源于鞍底以上,中斜坡脊索瘤起源于鞍底和蝶窦底之间,下斜坡脊索瘤起源于蝶窦底至颅颈交界区。C:图表显示了29年来三个时期(1991-2006年、2007-2015年和2016-2020年)手术入路的演变,并根据脊索瘤的位置。在最近两个时期,内镜经鼻入路是最常用于上、中斜坡脊索瘤。对于下斜坡/颅颈交界区脊索瘤,开颅手术在2016年之后成为主导
02 内镜经鼻入路VS开颅手术
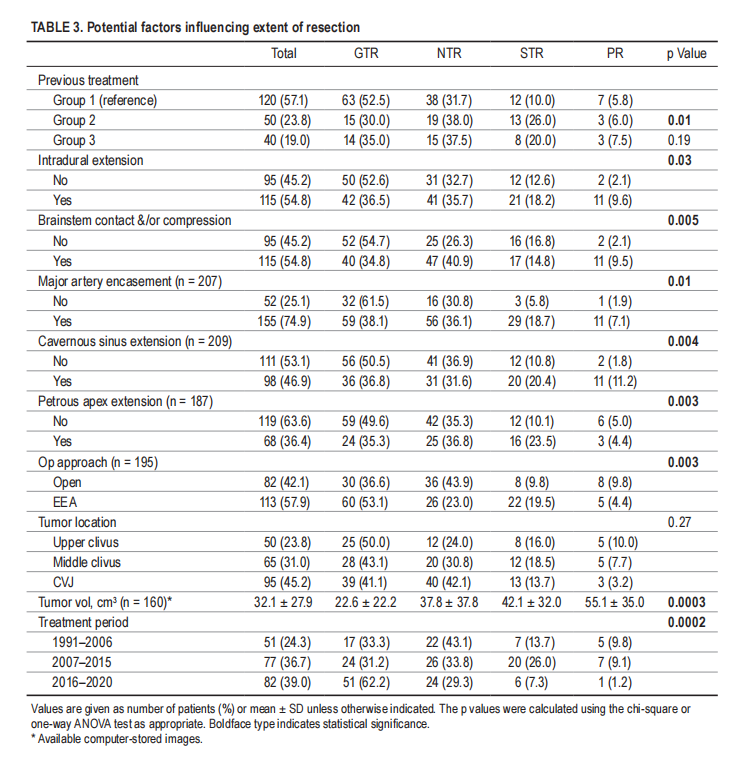
内镜经鼻入路提供直接的中线轨迹,利用天然的鼻腔和鼻副腔到达斜坡和颅颈交界区,而不需要在到达肿瘤之前穿过关键的神经血管结构。使用角度内窥镜,还可以达到横向延伸,能够保留经常被肿瘤横向推动的颅神经。凭借较高的切除率和较低的神经损伤率,Froelich教授的研究证实了内镜经鼻入路与开颅手术相比在治疗这些肿瘤方面的安全性和优势。然而,内镜经鼻入路与开颅手术相比更常用于小型脊索瘤,并且如表3所示,大型肿瘤体积限制了切除程度。开颅手术仍然是治疗具有明显向横向和硬膜内扩展的大型肿瘤的一个有价值的选择,这些肿瘤很难通过内镜经鼻入路到达,并且根治性切除率较低。
▼表3,影响切除程度的潜在因素
·对于颅颈交界区脊索瘤,Froelich教授改变了治疗理念,从2007年至2015 年期间的“全内镜经鼻入路策略”(根据经验,这会导致严重的鼻部发病率和脑脊液渗漏风险),改为在开颅手术和内镜经鼻入路之间采取更加平衡的策略。通过前外侧入路,特别是对于延伸至C2及以下的颅颈交界区脊索瘤,也可以在内镜帮助下从下斜坡和中斜坡以及对侧切除肿瘤。
·对于延伸至髁突或颈椎C1和C2段侧块的大型颅颈交界区病变,后外侧入路是另一种有价值的选择,提供了在同一手术中固定颅颈交界区的可能性。此外,对于后外侧入路,内镜辅助可以切除斜坡、C2和椎前间隙的延伸。这解释了在2016-2020年期间,越来越多地使用这种方法治疗下斜坡/颅颈交界区脊索瘤(图1C)。对于主要位于岩斜区、延伸至颈内动脉侧面和中颅窝的硬膜内脊索瘤,岩前后联合入路也被用作内镜经鼻入路的有价值的替代方法,提供肿瘤的多条视线,并允许更好的显微镜控制中枢神经和血管。最后,内镜和显微镜联合手术也是实现硬膜外和硬膜内巨大脊索瘤最大安全切除的一种选择。
03 颅底脊索瘤手术的主要挑战:预防脑脊液漏
脑脊液漏是颅底脊索瘤手术后最常见的并发症之一,特别是在内镜经鼻入路后,其发生率为0%至35.3%。本研究中脑脊液漏率总体:12.1%,内镜经鼻入路: 14.8%。脑脊液渗漏的预防是颅底脊索瘤手术的主要挑战,因为脑脊液渗漏会增加脑膜炎的风险,这可能与显著的发病率和死亡率相关。虽然内镜经鼻入路组脑脊液漏率较高(16.8% vs 12.2%),但与其他报告一致,差异无统计学意义。这可以解释为内镜鼻内颅底重建技术随着时间的推移而改进,正如文献中报道的脑脊液渗漏总体呈下降趋势所示。近年来,我们还观察到,使用Cavallo等人描述的3F技术(Fat, Flap, Flash),脑脊液漏率下降(从21.1%降至11.3%),在选定的病例中,在入路的最初和最后步骤,采用有针对性的斜坡入路,包括切口和关闭鼻窦粘膜,并结合蝶窦开颅术。值得注意的是,对于内镜经鼻入路, 2组患者或硬膜内延伸患者发生脑脊液漏的风险较高,这是颅底重建失败的危险因素。
04 切除范围受到哪些因素影响?
切除范围被普遍认为是影响无进展生存率和总生存率的重要因素。该研究中78.1%的患者实现了全切除和近全切除。如前所述,肿瘤体积,外侧延伸(海绵窦、岩尖)和硬膜内延伸是完全切除的限制。脑干接触关系和/或压迫和大动脉包裹也与较低的切除范围相关,并被描述为增加手术风险的因素,因此降低了完全切除的可能性。当不能实现全切除时,残留肿瘤的位置通常与血管或脑干接触,并且由于切除风险太大而“自愿”留在原位。
05 治疗理念改变会影响切除范围吗?
虽然治疗理念发生了变化,从不惜一切代价的根治性切除到考虑到维持生活质量的不那么激进的治疗策略,但是Froelich教授观察到29年间三个时期之间切除范围的还是显著改善。在第一阶段,考虑到大多数病例无法获得质子束放疗,手术的目标是实现全切除。在后期,引入内镜经鼻入路、术中监测工具和改进闭合技术,提高了切除范围,同时降低了手术风险。
06 为什么推荐“筷子技术”?
内镜经鼻入路具有显著的入路相关的发病率,保持过去经常被低估的鼻腔生活质量是颅底神经外科医生的下一个挑战,即使全切除仍然必须是脊索瘤手术的主要目标。为了提高生活质量,近年来,除了有针对性的入路外,我们更倾向于单鼻孔“筷子技术”,用于中线脊索瘤,允许外科医生在狭窄的通道内工作,并减少与入路和血管化鼻中隔皮瓣相关的发病率。
07 脊髓瘤预后因素有哪些?
5年无进展生存率和总生存率分别为52.1%和75.1%,其中平均5年无进展生存率和总生存率分别为59.2%和77.3%。
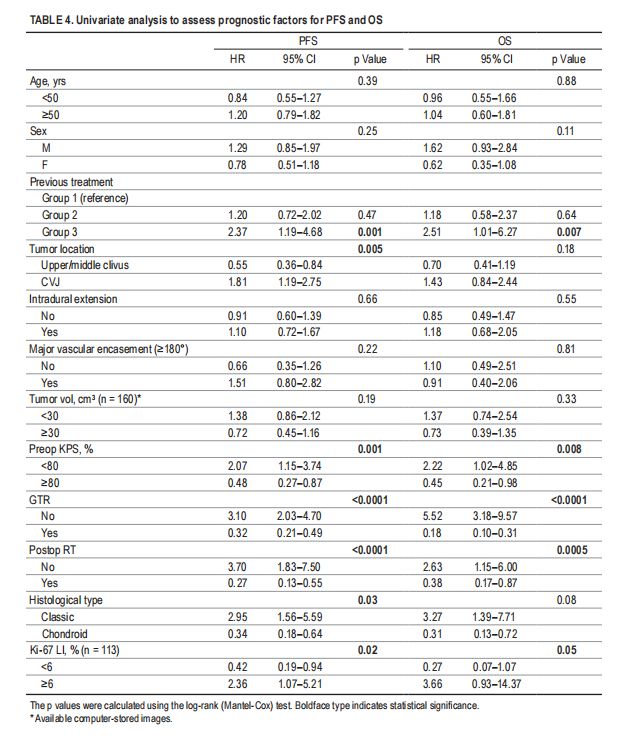
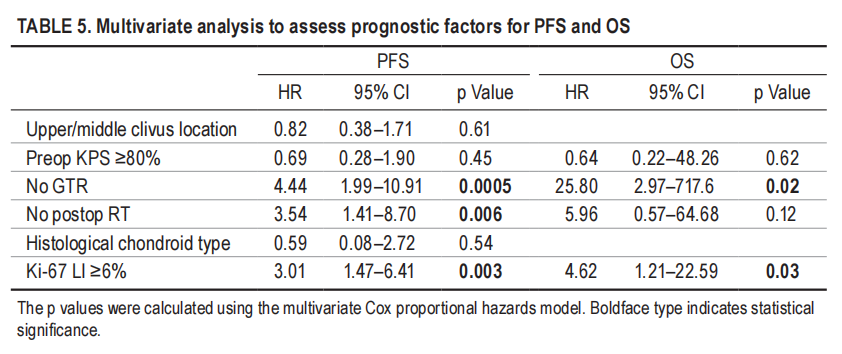
1、切除范围:与无进展生存率和总生存率改善相关的最强预后因素是切除范围。尽管一些研究质疑根治性手术的有效性,但大多数研究都支持切除“越多越好”的理念。在这项研究中,在单因素和多因素分析中,切除范围都是无进展生存率和总生存率的有利因素。
2、术后是否辅助放疗:在单因素分析中,术后辅助放疗也与无进展生存率和总生存率的改善密切相关,但在多因素分析中仅与无进展生存率相关(表4和5)。特别是,与其他治疗方案相比,接受全切除合并质子束放疗的患者的无进展生存率和总生存率明显更高(图2C–F)。
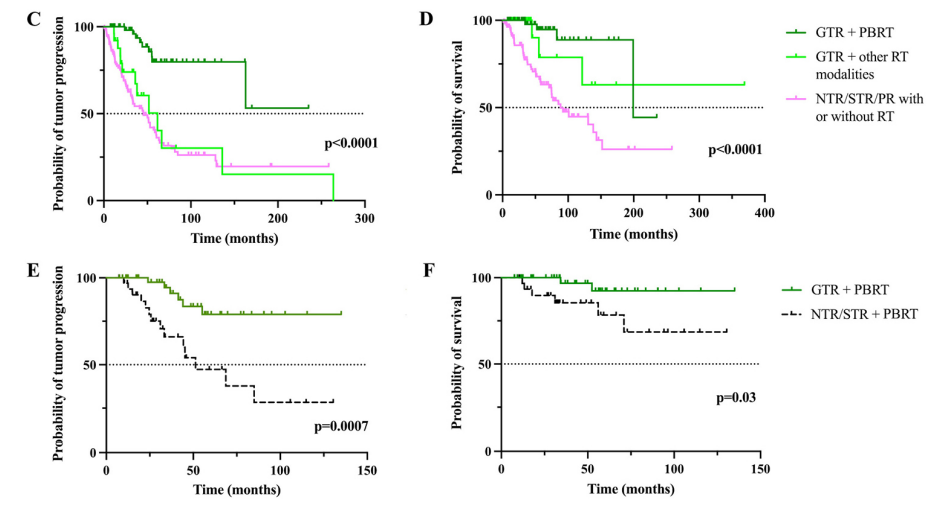
C和D:根据切除范围和辅助放疗的生存率的Kaplan-Meier曲线:无进展生存率 (C)和总生存率 (D)。与其他治疗方案相比,接受全切除 + 质子放疗的患者的无进展生存率和总生存率显着更高。
E和F:根据切除范围 (全切除 vs 近全切除/次全切除)和质子束放疗的生存率的Kaplan-Meier曲线:无进展生存率(E)和总生存率(F)。接受全切除后质子束放疗的患者的无进展生存率和总生存率比接受近全切除/次全切除后质子束放疗的患者更长。
▼表4,单因素分析评估无进展生存率和总生存率的预后因素
▼表5,多因素分析评估无进展生存率和总生存率的预后因素
3、在多学科颅底中心首次治疗的重要性:研究证实在颅底中心接受全切除 + 质子束放疗治疗的1组患者疗效更好。然而,我们没有观察到全切除 + 质子束放疗的1组和2组之间的生存差异,这表明在进行质子束放疗之前,应考虑在转诊中心进行第二次手术,进一步尝试完全切除(图G和H)。
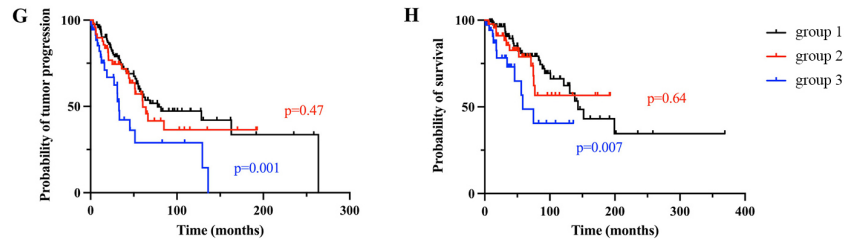
G和H: 1、2、3组的生存率Kaplan-Meier曲线:无进展生存率 (G)和总生存率(H)。1组:新诊断患者;2组:在另一机构接受不完全切除术的患者,并在放疗之前转到该院;3组:复发的患者,既往在其他机构进行过放疗、切除或活检后。1组的无进展生存率和总生存率显著高于3组,但1组与2组相比无显著差异。
4、脊索瘤的病理亚型、相关分子标志物:脊索瘤在生长特征和侵袭性方面存在重要的异质性。这种异质性强调了在术前和术后识别具有预后的临床、放射学和生物学标志物来评估脊索瘤侵袭性的重要性,这可以指导患者分类对应治疗。在术前,肿瘤生长速度与无进展生存率和术后Ki-67指数相关。最近,Zuccato等人首次使用基于血浆甲基化标志物鉴定了预后表观遗传脊索瘤亚型。在术后,免疫组织化学分级或生物分子标记,如PBRM1突变、CDKN2A/2B纯合缺失、1p36缺失等不良预后标记,可以提供预测颅底脊索瘤的预后表现,并根据其侵袭性调整辅助治疗。如果首次手术后生物标志物预后不佳且手术不完整,考虑到任何残留肿瘤生长的高风险,应建议进行积极的补充手术,然后进行质子束放疗。
08 颅底脊索瘤未来展望
Froelich教授认为对于颅底脊索瘤需要更有针对性的治疗策略,关注生活质量。根据术前和术后对肿瘤生物学行为的预测,可以针对特定患者提出适合的治疗方案,以避免不必要的治疗和潜在的并发症;并控制肿瘤。辅助放疗也可以相应调整。
考虑到手术的作用有限,再照射的风险增加,以及缺乏有效的药物治疗,颅底脊索瘤的局部复发仍然具有挑战性。随着最近放射方式的改进,如质子和碳离子,或立体定向放射外科治疗小局部复发,再放疗似乎是可能的。然而,第一次和第二次放疗之间的时间间隔以及最佳治疗方式需要进一步验证。
最后,目前在几个前瞻性试验中正在进行的靶向药物治疗将在颅底脊索瘤的管理策略中发挥重要作用,特别是对于无法通过手术或放疗治疗的局部或全身性疾病。


