【Blood Adv】DLBCL患者无残留淋巴瘤时接受CD19 CAR-T治疗安全有效
时间:2022-11-18 20:54:21 热度:37.1℃ 作者:网络
CD19 CAR-T
CD19 CAR-T 细胞疗法是复发/难治性 (R/R) 弥漫性大 B 细胞淋巴瘤 (DLBCL) 治疗的重大突破,来自关键性试验和真实世界实践的数据均证明了在这些难治性患者中的极佳疗效。然而CAR-T也可能具有独特的毒性,包括细胞因子释放综合征 (CRS)、免疫效应细胞相关神经毒性综合征 (ICANS) 和长期血细胞减少。数据表明治疗前疾病负荷与 CAR-T 细胞治疗后的毒性和结局相关,但由于CAR-T细胞动力学会受到CAR与其靶抗原结合的影响,因此治疗前疾病负荷可能是CAR-T细胞扩增的先决条件,从而影响治疗结局。
2019年Bishop等报告了7例无残留疾病的患者输注tisagenlecleucel (tisa-cel)的结局,治疗后1年5例 (71%) 仍处于缓解状态,且CAR-T细胞扩增峰值和毒性与原始 JULIET 队列相当,但此研究的病例少且仅使用tisa-cel。
近日《Blood Advances》报道了纪念斯隆凯特琳癌症中心Miguel-Angel Perales教授等分析的33例 CAR-T 细胞输注时无残留疾病的 R/R DLBCL 患者的真实世界数据,可以为我们提供更多的见解。

研究结果
本项回顾性多中心分析纳入了在8家美国学术中心接受市售 CAR-T 细胞治疗(axi-cel或tisa-cel)的≥18岁 DLBCL 成人患者,数据采集时间为2018年05月01日至2021年06月30日。在研究期间接受 CD19 CAR-T 细胞治疗的364例患者中,33例患者是在疾病状态为 CR 且无残留疾病时接受 CD19 CAR-T 细胞治疗(9例 axi-cel 和24例tisa-cel)。表1为CAR-T 细胞治疗时未检测到疾病的33例患者的基线特征和详细信息,中位年龄为63.8岁,CAR-T 细胞治疗的适应症包括23例 R/R 原发DLBCL、5例高级别 B 细胞淋巴瘤 (HGBL) 和6例转化DLBCL。
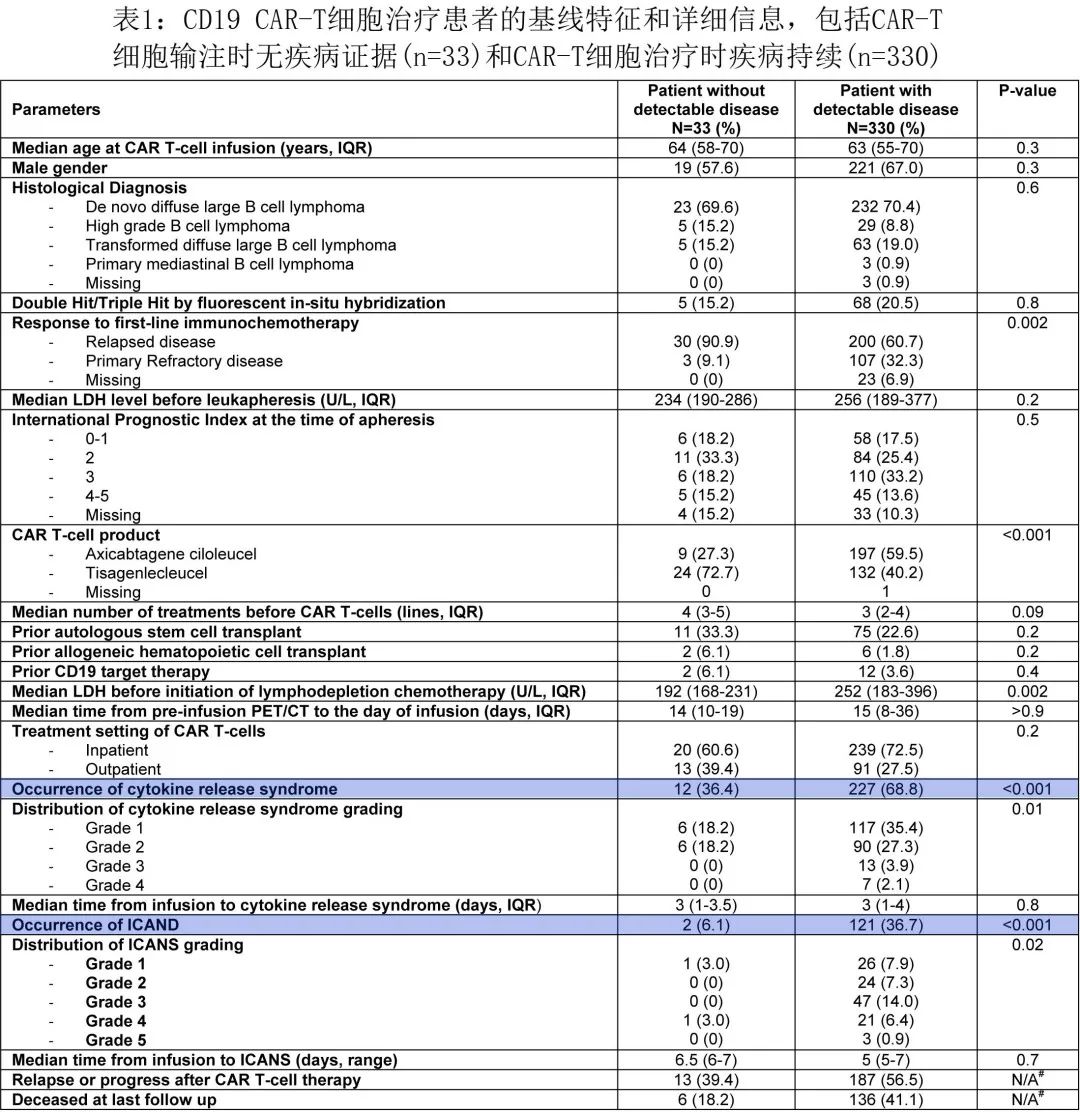
33例患者中,26例 (78.8%) 在白细胞单采时有可测量的疾病,并在桥接治疗(全身治疗n= 20,放疗n= 4和皮质类固醇n= 2)后达到CR,其余7例在白细胞单采前达到 CR 的患者为高危疾病(包括5例接受多线治疗的患者、1例 ASCT 后复发和1例不适合ASCT)。从白细胞单采至 CAR-T 细胞输注的中位时间为48天,从输注前 PET-CT 至 CAR-T 细胞输注的中位时间为14天。清淋化疗是根据具体CAR-T药品说明书进行的,在接受 tisa-cel 的24例患者中,15例患者给予苯达莫司汀,剩下9例tisa-cel患者和所有 axi-cel 治疗患者均接受氟达拉滨和环磷酰胺。与可检测疾病的患者相比,输注时无残留疾病的患者中原发难治性疾病的比例较低,同时治疗前中位LDH 较低(表1)。
12例患者 (36.3%)(包括9例 axi-cel 中的5例和24例 tisa-cel 中的7例)发生CRS,中位发作时间为输注后3天,未发生≥3级 CRS 事件。4例患者接受托珠单抗、2例患者接受标准剂量糖皮质激素(≤40 mg/天地塞米松或等效药物)用于治疗CRS。2例患者 (6.1%) 发生需要糖皮质激素治疗的ICANS(1级n = 1和4级n = 1,均为axi-cel治疗)。CAR-T 细胞治疗时无残留淋巴瘤患者的 CRS 和 ICANS 发生率显著降低(表1)。需要注意的是,与有疾病的患者相比,无残留疾病的患者中 tisa-cel 的使用率显著更高 (72.7% vs 40.2%),这可能在一定程度上解释了CRS 和 ICANS 的差异,因为tisa-cel的CAR-T 毒性发生率低于axi-cel,且本研究中axi-cel更多用于残留疾病患者队列。
第+100天时有26例患者 (78.8%) 仍处于缓解状态(3例在前30天内复发)。前100天内无给药相关死亡,≥3级长期血细胞减少(>28天)的发生率较低(3例患者≥3级中性粒细胞减少,4例患者≥3级血小板减少),仅1例患者 (3%) 发生4级中性粒细胞减少,2例患者 (6%) 发生4级血小板减少(需要促血小板生成素受体激动剂)。
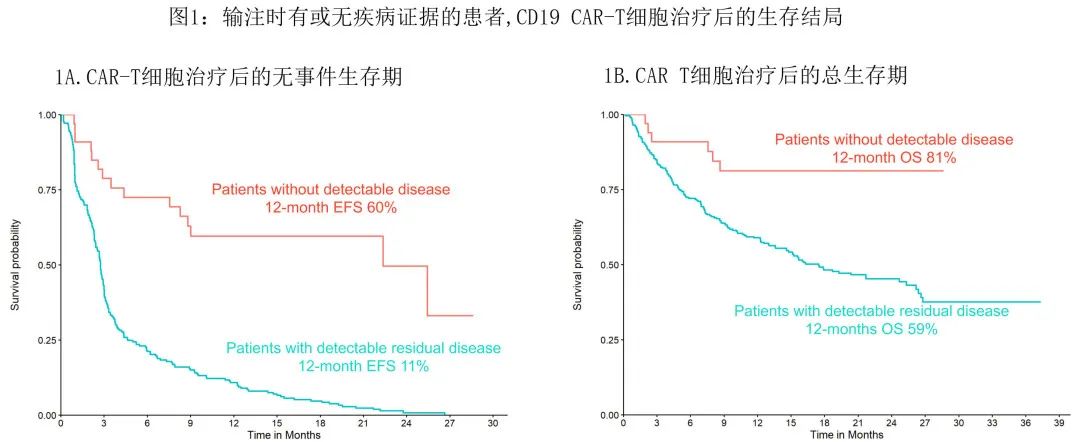
数据截止时中位随访16个月,13例患者 (39.3%) 复发,1年复发率为37.3%(4例DLBCL,1例HGBL)。在 CAR-T 细胞治疗后复发的13例患者中,8例患者复发时的 CD19 状态可用,包括6例CD19+复发患者。截至末次随访时,6例患者 (18.1%) 死亡,死亡原因包括5例患者疾病进展和1例患者治疗相关MDS。输注时33例无残留疾病患者的1年 EFS 和 OS 分别为59.6%(和81.3%,显著高于 CAR-T 细胞输注时可检测疾病的患者(图1)。
讨论
虽然本报告中的患者数量相对较少,但这是迄今为止相关领域最大的研究,同时也是真实世界实践。本研究证实,在输注时未检测到疾病的患者中使用 CAR-T 细胞的安全性和结局均极佳,这33例患者的生存期似乎优于 CAR-T 细胞输注时疾病持续的患者,强调了治疗前疾病负荷可显著影响 CAR T 细胞的安全性和有效性。
本研究中 CRS 和 ICANS 的发生率较低。本研究也表明,输注时具有显著的疾病负荷并非 CAR-T 细胞功能的先决条件。
治疗 CR 患者的一个潜在问题是没有抗原刺激驱动 CAR T 细胞扩增,但本研究中确实观察到 CRS 和 ICANS ,表明 CAR T 细胞是存在扩增的,这可能部分由残留正常 B 细胞所驱动。此外虽然临床前数据显示,淋巴细胞减少的情况下 T 细胞的最佳扩增是由特异性抗原识别所驱动,但 T 细胞也部分通过稳态增殖扩增。本研究中有3例 CAR T 细胞输注后早期复发,可解释为内源性 CAR T 细胞缺陷或其他宿主相关因素。
虽然关键研究中关于桥接治疗的建议非常具体,但真实世界数据显示,临床医生越来越多地在患者(包括 axi-cel 接受者)中使用桥接治疗,通常是化学免疫治疗。桥接的潜在获益是肿瘤负荷降低,可能转化为更高的疗效和更低的毒性。但患者也可能出现与桥接治疗相关的并发症,可能导致治疗延迟,甚至无法继续接受 CAR-T 细胞治疗,或桥接治疗时进展而导致肿瘤负荷增加。桥接治疗数据的解释也可能受到选择偏倚的影响,输注时无残留疾病的患者可能是生物学上不同的患者组,与疾病负荷较高的患者相比,治疗后表现良好的概率较高。与疾病负荷较高的患者相比,较低的基线疾病负荷也可能提供理想的效应物与靶标比值,而需要桥接的患者可能患有高度增生性疾病,不太可能对 CAR T 细胞产生反应。总之,桥接治疗以及最佳桥接治疗的确切作用和/或获益仍是一个悬而未决的问题。
本研究支持在前瞻性试验中进一步探索 CAR-T 用于无可测量疾病患者,以更好地理解 CAR-T作为巩固治疗的影响。
参考文献
Wudhikarn K,et al.Low toxicity and excellent outcomes in patients with DLBCL without residual lymphoma at the time of CD19 CAR T-cell therapy.Blood Adv . 2022 Nov 10;bloodadvances.2022008294. doi: 10.1182/bloodadvances.2022008294.
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


