恶心呕吐皮肤黑,ACTH来解密
时间:2022-10-24 15:01:07 热度:37.1℃ 作者:网络
1
前言
肾上腺皮质功能减退症按照病因可分为原发性和继发性两大类[1]。原发性肾上腺皮质功能减退症中最常见的是Addison病,是由于结核、肿瘤、感染、自身免疫等原因破坏了双侧肾上腺皮质绝大部分而引起皮质激素分泌不足所致的疾病,临床上大多同时有肾上腺糖皮质激素(皮质醇)和盐皮质激素(醛固酮)分泌不足的表现。继发性是由于下丘脑或垂体等病变引起ACTH分泌不足所致。这类疾病起病隐匿,初期症状轻、不典型,临床表现有虚弱无力、食欲减退、消瘦、低血压、直立性晕厥、女性腋毛和阴毛稀少或脱落等。
2
案例经过
患者为65岁女性,入院前半月无明显诱因下出现恶心呕吐,呕吐6-8次,为胃内容物,量中,有皮肤色素加深,伴乏力、嗜睡、反应迟钝,无发热,无腹痛腹泻,无咳嗽咳痰,无胸闷气促,无视物模糊等不适。至青浦中医院查胃肠镜示:慢性萎缩性胃炎伴糜烂,食管下段黏膜下隆起(建议超声内镜检查)。遂就诊上海市第一人民医院完善超声内镜提示:食管下段多发黏膜下隆起(考虑平滑肌瘤可能);纵膈囊性占位 (建议增强CT);食管下段固有肌层明显增厚。患者于2021年11月3日 再次因恶心呕吐,就诊我院急诊,查:电解质:钾 4. 8 mmol/L ,钠 122 mmol/L,氯 87 mmol/L,钙 2. 59 mmol/L ,淀粉酶49IU/L ,血酮阴性。上腹部CT:左侧膈脚椎旁间隙占位,考虑良性肿瘤,前肠囊肿可能,神经源性肿瘤待排,请结合临床及随访;左肾小囊肿;附见左肺下叶支扩伴感染。急诊予以补钠对症处理,为进一步明确低钠病因, 2021年11月6 日因“反复恶心呕吐半月”收住入院。患者自起病以来,精神萎,胃纳差,大小便如常,近期体重下降5kg。有糖尿病病史10余年,目前口服二甲双胍0. 5g qd降糖治疗,随机血糖在5mmol/L左右;有高血压病史2年,最高收缩压150mmHg左右,至今未服药。传染病史、手术外伤史、过敏史、婚育史、家族史均无殊。
3
案例分析
临床案例分析
临床表现:该患者为老年女性,以非特异性上消化道症状为主,伴乏力、体重减轻,要警惕胃肠道、肝脏疾病的可能性;患者乏力、体重减轻也要与血液系统疾病相鉴别。另外,患者皮肤色素沉着,从内分泌角度首先考虑肾上腺皮质功能减退,常有软弱无力、食欲减退、体重下降等表现。追问病史,患者否认胃病、肝病史,否认齿龈出血、骨痛史,否认腹泻及黑便史。
入院查体:T 36.5℃、P 86次/分、R 19次/分、BP 114/68 mm Hg。
BMI:20.03kg/m2 ;腰围:76cm;臀围:84cm; 腰/臀:0.91 。
神志清楚,精神一般,呼吸平,无烂苹果味,体型中等,步入病房。面部、齿龈、舌部、掌纹、束腰带、乳晕周边皮肤色素加深,双手双足指甲色素加深,部分呈黑色(图1),无瘀点瘀斑,眉毛、腋毛无稀疏,无贫血貌,无脱水貌,无肝掌、蜘蛛痣。余体格检查无殊。
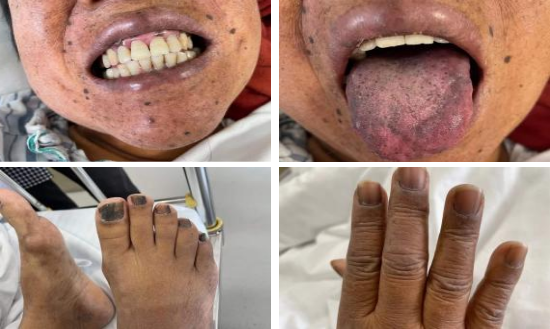
图1 患者面部、齿龈、舌部、双手双足指甲色素加深
辅助检查:血常规、尿、便常规、凝血五项、心肝肾功能正常。电解质:钾4.3mmol/L ,钠131mmol/L,氯96mmol/L,钙2.49mmol/L ;糖化血红蛋白:6.4%;血清皮质醇(F)8:00为<10mmol/L(172~497mmol/L),16:00为<10mmol/L(71.1~286mmol/L),24:00为<10mmol/L(35.5~143mmol/L);血清促肾上腺皮质激素(ACTH)于8:00为>2000ng/L(10~80ng/L),16:00为>2000ng/L(5~40ng/L),24:00为>2000ng/L(5~10ng/L);24小时尿皮质醇 6.3ug/24h。心电图未见明显异常。肺CT示:两肺慢性炎症,左肺下叶支气管扩张伴感染,建议随访。冠脉硬化。附见甲状腺肿大,左侧膈脚椎旁间隙占位。
结合患者病史、体格检查及实验室检查结果,患者原发性肾上腺皮质功能减退诊断明确。需进一步实验室及影像学检查以明确病因诊断。
甲状腺功能:三碘甲状腺原氨酸(TT3)3.56 nmol/L,甲状腺素(TT4) 104.00nmol/L,游离三碘甲状腺原氨酸 (FT3) 6.67 nmol/L, 游离甲状腺素(FT4) 12.50nmol/L, 促甲状腺激素(TSH)8.640mIU/L,甲状腺过氧化物酶抗体(TPO-AB)223 IU/ml,甲状腺球蛋白抗体(TG-AB)1834 mIU/ml。血清固定免疫电泳:免疫球蛋白A:阳性;轻链Lambda型:阳性。性激素全套中睾酮(T)<0.025ng/ml,余无异常。血沉结果正常。糖尿病自身抗体阴性。T-SPOT阴性。结核抗体阴性。抗核抗体、ENA抗体谱阴性。肾上腺增强CT示:两侧肾上腺形态、密度未见明显异常,增强后未见明显异常强化;脊柱左侧缘膈脚后方约左肾上腺水平可见类圆形异常密度影,边界清楚光滑,大小约30mm×35mm,内部密度基本均匀,边缘少许弧形钙化,增强后病灶未见明显增强;双肾小囊肿。垂体动态增强MRI未见明显占位灶,附件右筛窦区异常信号。甲状腺B超示:甲状腺两叶弥漫性肿大伴弥漫性病变,甲状腺两叶实性结节,双侧颈部见淋巴结。
基于以上结果,推测该患者原发性肾上腺皮质功能减退可能是由于自身免疫所致,同时伴自身免疫性甲状腺炎,考虑自身免疫性多发内分泌腺病综合征可能。
原发性肾上腺皮质功能减退症的病因现主要有特发性(包括自身免疫性和多内分泌腺功能减退综合征)占65%,其次为结核,约占20%,其他病因占 15%。半数以上的特发性肾上腺皮质萎缩患者中可检测到针对肾上腺皮质的抗体,而细胞毒性的T淋巴细胞亦是其病因。其中50%左右同时可伴有其他自身免疫性内分泌疾病,被称为自身免疫性多发内分泌腺病综合征(polyglandular autoimmune syndrome,PAS)[2]。Ⅱ型自身免疫性多发内分泌腺病综合征常包括肾上腺皮质功能减退(100%)、自身免疫性甲状腺炎(70%)和1型糖尿病(50%),同时也可有卵巢早衰、恶心贫血、白癜风、脱发等,具有“显性”遗传特征,与B8、DR3/DR4相关联,并发现其与第6对染色体的基因突变有关[3]。在大多数患者血循环中,存在一种或数种针对内分泌腺的自身抗体。
该患者经糖皮质激素替代治疗(醋酸泼尼松)、降糖(二甲双胍)以及降压(非洛地平缓释片)治疗后,患者恶心、呕吐、乏力等症状明显改善,初步判断患者恢复情况良好。2021年12月6日,随访患者皮肤变黑情况较前有所好转(图2),复查电解质:钾4.1mmol/L ,钠137mmol/L,氯99mmol/L,钙2.41mmol/L ;血清促肾上腺皮质激素(ACTH)于8:00为1080ng/L(10~80ng/L)。
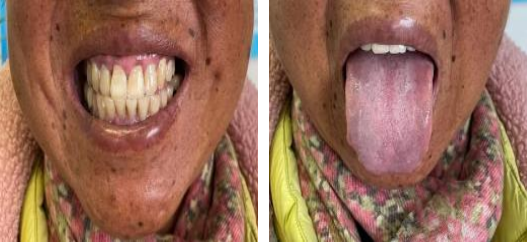
图2 患者面部、齿龈、舌部色素变浅
检验案例分析
思路1∶血浆皮质醇、ACTH及24小时尿游离皮质醇检测是诊断肾上腺皮质功能减退症的重要指标。
不论原发性还是继发性肾上腺皮质功能减退症患者,皮质醇的分泌均出现明显降低。正常人的血皮质醇以上午最高,午夜最低,男女无显着性差异。Addison病的皮质醇水平不但出现明显降低,而且昼夜节律消失。检查时一般于早晨8∶00和下午4∶00采血测定,必要时午夜加测一次。血皮质醇(F)水平受很多因素影响,本身的波动很大,一般认为血浆皮质醇水平基础值<82.8mmol/L(3μg/dl)可确诊为肾上腺皮质功能减退症,而血 F>552mmol/L(20μg/dl)可排除此病。
检测 24小时尿游离皮质醇(UFC)或17-羟皮质类固醇(17-OHCS)可避免血F的昼夜节律及上下波动的影响,更能反映肾上腺皮质功能的实际情况。严重的肾上腺皮质醇功能减退症患者由于血皮质醇基础值明显降低,尿游离皮质醇及17-OHCS亦低于正常。
需要注意的是,皮质醇浓度因使用的化验方法而异,因此,建议与相关实验室核对参考范围[4]。此外,妊娠和口服雌激素治疗,这可能导致皮质类固醇结合球蛋白浓度增加,掩盖肾上腺功能不全。相反,许多情况,包括炎症、脓毒症、肝硬化等都会降低皮质类固醇结合球蛋白的浓度[5]。有意思的是,目前质谱学分析提高了检测的特异性,比免疫分析法检测到更低的皮质醇浓度[6]。
原发性肾上腺皮质功能减退症患者由于双侧肾上腺大面积损伤,血皮质醇水平明显隆低进而反馈性地引起 ACTH 的分泌上升,血 ACTH水平应明显高于参考区间,多数超过55pmol/L,常达88~440pmol/L(参考区间为1.1~11pmol/L),而继发性肾上腺皮质功能减退者血浆ACTH浓度极低,因此血浆 ACTH 正常能排除慢性原发性肾上腺皮质功能减退症,但不能排除轻度的继发性肾上腺功能减退。
思路2∶ACTH检测、ACTH兴奋试验,肾上腺和蝶鞍的影像学检查如 CT、MRI等有助于定位诊断。
ACTH兴奋试验可用于检测肾上腺皮质的贮备功能[7-8],有助于发现轻型慢性肾上腺皮质功能减退症患者及鉴别原发性与继发性慢性肾上腺皮质功能减退症。在进行性肾上腺损伤的早期阶段,常规实验室检查难以发现异常,当肾上腺储备功能出现下降时,基础的皮质醇浓度可正常,但应激后激素升高反应低于正常。在疾病的这一阶段,ACTH兴奋试验可揭示肾上腺异常,可发现皮质醇水平升高低于正常。
快速 ACTH1-24[9]∶所有怀疑存在肾上腺皮质功能减退者都可进行快速 ACTH兴奋试验以确诊。简化方法;静脉注射ACTH 250ug,分别于0、30和 60分钟后复查血浆皮质醇浓度。结果判断∶①正常反应∶基础或兴奋后血 F≥552nmol/L(20μg/dl);②原发性肾上腺皮质功能减退症∶由于内源性 ACTH已经最大限度地兴奋肾上腺分泌皮质醇,因此,外源性ACTH不能进一步刺激皮质醇分泌,血 F基础值低干参考区间或在参考区间低限.刺激后血F很少上升或上升不明显;③继发性肾上腺皮质功能减退症:血 F呈低反应或无反应。如连续注射ACTH 3~5天,则血F能逐渐上升改善,为迟发反应。
思路 3∶TSPOT、血清结核抗体;肾上腺自身抗体及免疫学指标等进行病因检测。
TSPOT、血清结核抗体和结核分枝杆菌基因检测有助于结核病的确诊。伴1型糖尿病者应明确是否为1型自身免疫性糖尿病,伴甲状腺功能减退者应测定甲状腺自身抗体。如果发现血钙降低,应进一步检测血 PTH。若有月经稀少或闭经,应测定血 FSH 和 LH。美国内分泌协会[10]建议所有年龄大于6个月的Addison病患者需接受21羟化酶抗体检测,以此判断病因是否来自自身免疫。
4
知识拓展
Addison病共同的病理机制包括肾上腺皮质激素分泌不足和 ACTH分泌增多,在典型的Addison病中,肾上腺破坏一般都在 90% 以上,通常同时累及束状带、网状带和球状带,导致糖皮质激素和盐皮质激素同时缺乏,在女性,雄激素分泌减少[9]。皮质醇分泌减少导致对 ACTH反馈抑制程度减弱,血浆 ACTH水平明显升高。糖皮质激素缺乏表现为乏力、纳差、恶心和体重下降;糖异生减少,肝糖原消耗,对胰岛素敏感性增加,易出现低血糖;免疫力低下易患各种感染;ACTH 增多引起皮肤、黏膜色素沉着,近年来发现个别患者因内在黑色素细胞缺陷,不出现色素沉着。盐皮质激素缺乏,失钠增多,出现低钠血症和轻度代谢性酸中毒。加之糖皮质激素对儿茶酚胺的作用减弱,心排血量和外周阻力下降,进一步加重直立性低血压。
患者临床表现常为软弱无力和疲劳,因此早期肾上腺皮质功能减退症的诊断困难。如合并轻度胃肠道不适、体重减轻、食欲不振,以及皮肤色素沉着加重,选择 ACTH兴奋试验可协助诊断,尤其是在开始甾体激素治疗之前。面部色素沉着可能是疾病的表现,进行性肾上腺损害的患者可出现新发、进行性加重的色素沉着,但当肾上腺快速损伤,例如双侧肾上腺出血情况下通常不会出现过度色素沉着。过度色素沉着合并其他疾病也可能有提示意义,但肾上腺皮质功能减退症引起的色素沉着其外观和分布具有特征性,如不明确,则可测定 ACTH水平,或行ACTH兴奋试验了解肾上腺储备功能可明确鉴别。
5
案例总结
自身免疫性多内分泌腺病综合征是一种罕见病复杂病,指同一个体中发生2个及以上内分泌腺体的自身免疫性病变,但非内分泌器官也可受累的一类疾病,根据病因及临床特征可将其分为2型,即 APS Ⅰ型和 APS Ⅱ型。Addison病是 APSⅠ型和Ⅱ型共同的重要组成成分。本例患者根据病史、皮质醇、ACTH、甲状腺激素和影像学等检查结果,该患者可做以下诊断∶APS Ⅱ型(自身免疫性肾上腺皮质功能减退合并自身免疫性桥本甲状腺炎)。诊断依据为∶①患者皮质醇水平出现明显降低,促肾上腺皮质激素水平显着上升;②患者血清甲状腺过氧化物酶抗体和甲状腺球蛋白抗体水平显着上升;③患者无长期应用糖皮质激素、放化疗史、结核感染、真菌感染及艾滋病病史;④肾上腺增强CT未见明显异常。
原发性肾上腺皮质功能减退症与其他自身免疫性疾病相关,如APSⅠ型和APSⅡ型。该病的早期发现,早期干预治疗,不仅可有效缓解肾上腺破坏的进程,而且对全身其他器官可能存在的免疫损伤也有治疗作用。另外,原发性肾上腺皮质功能减退症临床症状多为非特异性,病程进展缓慢,早期多不被患者察觉,直到皮肤变黑后才就医,约50%有临床症状的 Addison病患者在症状出现1年后才被确诊。皮肤、黏膜色素沉着是诊断原发性肾上腺皮质功能减退症的特征性症状,少数原发性肾上腺皮质功能减退症无明显色素沉着,可能的原因是基础血皮质醇水平还足以对下丘脑-垂体起负反馈作用,或病情进展较快,患者容易出现死亡。少数患者症状、体征不突出,其诊断需要配合有关实验室检查及鉴别诊断后方能明确。
因此,对临床表现疑似肾上腺皮质功能减退症的患者应该行基础血皮质醇和 ACTH水平检测,如有必要,再结合功能试验进一步鉴别其为原发性或是继发性,最后可选择TSPOT、血清结核抗体、相关免疫学指标、肾上腺自身抗体以及基因检测等进行病因诊断。
6
专家点评
龚倩,复旦大学附属中山医院青浦分院检验科主任
本案例从患者的典型临床表现入手,以实验室检查为主线,通过检测不同时间点血皮质醇、不同时间点血ACTH及24小时尿游离皮质醇,结合定位诊断以及病因探索,详细阐述Addison病临床表现和实验室特征,内容较完整,思路清晰。
实验室的检测结果直接指导了临床的诊断,从本例可看出实验室检测能力为患者的临床诊断和治疗提供了很大的帮助。
参考文献
1.Husebye ES, Pearce SH, Krone NP, Kampe O. Adrenal insufficiency. Lancet 2021, 397(10274): 613-629.
2.童南伟,邢小平主编;郭小蕙等副主编. 内科学 内分泌科分册. 人民卫生出版社: 北京, 2015.
3.Hahner S, Ross RJ, Arlt W, Bancos I, Burger-Stritt S, Torpy DJ, Husebye ES, Quinkler M. Adrenal insufficiency. Nat Rev Dis Primers 2021, 7(1): 19.
4.El-Farhan N, Pickett A, Ducroq D, Bailey C, Mitchem K, Morgan N, Armston A, Jones L, Evans C, Rees DA. Method-specific serum cortisol responses to the adrenocorticotrophin test: comparison of gas chromatography-mass spectrometry and five automated immunoassays. Clin Endocrinol (Oxf) 2013, 78(5): 673-680.
5.Verbeeten KC, Ahmet AH. The role of corticosteroid-binding globulin in the evaluation of adrenal insufficiency. J Pediatr Endocrinol Metab 2018, 31(2): 107-115.
6.Ueland GA, Methlie P, Oksnes M, Thordarson HB, Sagen J, Kellmann R, Mellgren G, Raeder M, Dahlqvist P, Dahl SR, Thorsby PM, Lovas K, Husebye ES. The Short Cosyntropin Test Revisited: New Normal Reference Range Using LC-MS/MS. J Clin Endocrinol Metab 2018, 103(4): 1696-1703.
7.Dickstein G, Shechner C, Nicholson WE, Rosner I, Shen-Orr Z, Adawi F, Lahav M. Adrenocorticotropin stimulation test: effects of basal cortisol level, time of day, and suggested new sensitive low dose test. J Clin Endocrinol Metab 1991, 72(4): 773-778.
8.Oelkers W. The role of high- and low-dose corticotropin tests in the diagnosis of secondary adrenal insufficiency. Eur J Endocrinol 1998, 139(6): 567-570.
9.王前,王建中主编;府伟灵,李莉,续薇,欧启水副主编. 临床检验医学. 人民卫生出版社: 北京, 2015.
10.Bornstein SR, Allolio B, Arlt W, Barthel A, Don-Wauchope A, Hammer GD, Husebye ES, Merke DP, Murad MH, Stratakis CA, Torpy DJ. Diagnosis and Treatment of Primary Adrenal Insufficiency: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2016, 101(2): 364-389.


